概 論
炎症は抗腫瘍免疫の敵か味方か?
西川博嘉
(名古屋大学大学院医学系研究科微生物・免疫学講座分子細胞免疫学/ 国立がん研究センター研究所腫瘍免疫研究分野)
[略語]
- CTLA-4:
- cytotoxic T-lymphocyte-associated antigen(protein)4
- HPV:
- human papillomavirus(ヒトパピローマウイルス)
- PD-1:
- programmed death 1
- Treg:
- regulatory T cell(制御性T細胞)
はじめに
炎症は生体に何らかの変化をきたす外的および内的要因による侵襲がもたらされた際に自身の恒常性を維持するための生体の防御反応である.侵襲としては,寒冷刺激や機械刺激などの物理的刺激,有機,無機物質などの化学的刺激や細菌,ウイルスによる生物学的な刺激があげられ,生体はこれらの刺激による侵襲が大きな障害を引き起こさないように炎症反応を誘導する.炎症反応は,発赤,発熱,疼痛,腫脹および機能障害の五兆候に代表される変化をもたらす.局所(炎症部位)で血漿成分が血管壁の透過性亢進により血管外に滲出し,これとともに好中球やマクロファージが血管外に遊走する.これらの細胞や血管内皮細胞から化学メディエーターが放出され,さらなる免疫細胞浸潤が起こり,侵襲が除去されて肉芽組織の形成や線維化が生じて治癒に向かう.
多くの場合は侵襲の原因となる刺激が排除され,炎症反応は終息にむかう.しかしながら,侵襲が排除されずに残存する場合は,炎症が持続して慢性炎症が引き起こされる.1863 年にRudolf Virchow は,がん組織に白血球が浸潤していることを観察し,がんも慢性炎症を伴って発生することを主張した1).正常組織が侵襲を受けて生じた炎症に起因して細胞増殖が惹起されてがんに至る,という考えは現在の知見に一致するもので,Virchowが近代病理学の祖と言われるゆえんでもある.
一方,CTLA-4やPD-1に代表される免疫チェックポイント分子に対する阻害剤の臨床的成功はがん免疫療法をがん治療の重要な柱に押し上げた.がんに対して免疫応答が誘導される,という概念は,William Coleyにより1893年に「免疫応答により悪性腫瘍が退縮する」ことが報告されたことにはじまる2).この後がんに対する免疫応答の存在は盛衰をくり返しながら発展し,その研究成果が免疫チェックポイント阻害剤の臨床応用をもたらしたことから,Coleyはがん免疫療法の父ともよばれている.
このように生体にもたらされる免疫系の反応(炎症反応)が発がんとがん治療という全く異なる側面をもつことが明らかになってきた.さらに炎症が持続してもがんに至らない場合もある一方で,がん免疫療法の効果もすべての患者で認められるわけではない.では,このような炎症反応の複雑なパズルをどう考えればよいのか?発がん―がんの進展―がん治療の経過を考慮しつつ,がんを誘発,促進する炎症(生体にとって悪い炎症:敵)とがんを駆逐する炎症(生体にとって良い炎症:味方)という視点から考えてみたい.
1.慢性炎症はがんを誘発,促進する(悪い炎症)
持続する炎症によってがんが引き起こされる,という仮説は,煙突掃除人に皮膚の扁平上皮癌が多いことをもとに,1775年Pott Percivallによって述べられたChimney sweep’s cancer(煙突掃除人がん)にはじまる.その後,Virchow によって病理学的な観察に基づく概念の構築により,慢性炎症が発がんにつながると考えられるようになった.しかし,実際に炎症惹起物質による発がんの確認は,山極勝三郎によるウサギの耳へのコールタールの塗擦による人工がんの発生による3).その後の研究により,ベンゾ[a]ピレンなどの多環芳香族炭化水素に代表される化学物質がDNA損傷をきたすことで発がんに至ることが示された.また,このような発がん性の物質を含むタバコなどによる刺激で発がんが誘発されることがよく知られている.
さらに1911年Peyton RousによってRous sarcoma virusが発見され,ウイルス感染が遺伝子変異を誘発することで発がんの原因となることが明らかになった4).その後Robert WeinbergによるRasの発見にはじまるがん遺伝子,がん抑制遺伝子の発見に基づいて,遺伝子変異が蓄積することにより発がんに至るという「多段階発がん説」がBert Vogelsteinらによって唱えられた5).ここでは,遺伝子変異に基づいてinitiation,promotion,progressionとがんが進展することが述べられている.さらに,Weinbergらによって2000年に発がん過程がThe Hallmarks of Cancerとしてまとめられた6).興味深いことに,これらの説においては遺伝子変異に基づく発がん過程が述べられているものの,炎症の関与については深くは触れられていなかった.その後2011年の新たな知見に基づいたHallmarks of Cancer : The Next Generationでは,「tumor promoting inflammation」として炎症反応の重要性が述べられている7).さらに2022年アップデートされたHallmarks of Cancer : New Dimensionsでは炎症反応に影響を与える環境因子等の重要性も追加され8),19世期の後半から述べられていた炎症反応の重要性が再考され,再度広く理解されるに至ったといえる.
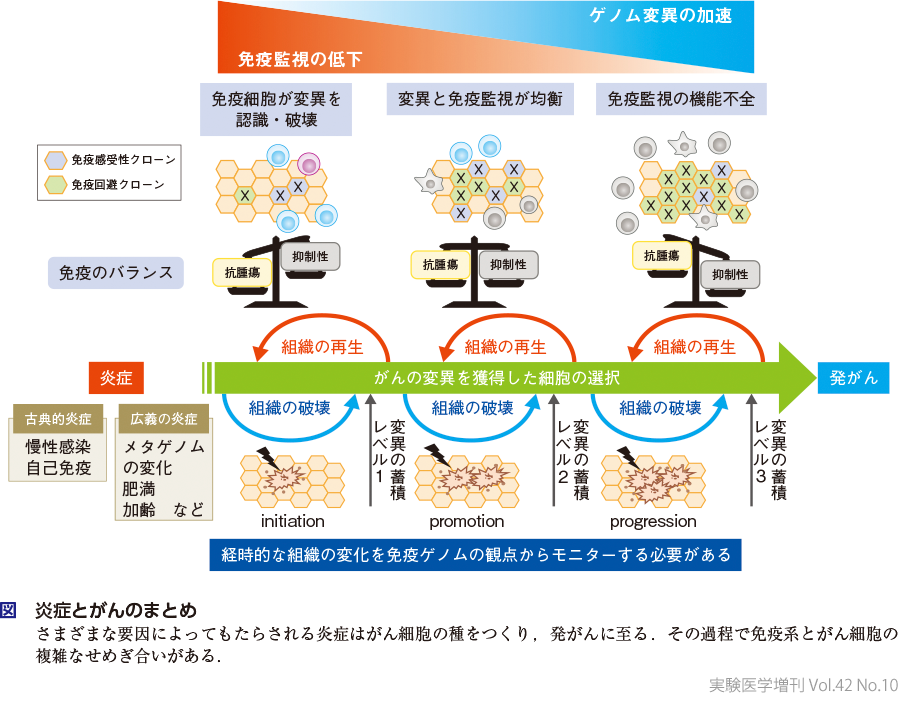
炎症を惹起してがんに至る因子としてHPV感染,肝炎ウイルスやH. pylori(ピロリ菌)などの感染症や炎症性腸疾患が広く知られている.近年,炎症の理解が進むにつれ,加齢に伴い多くの組織に慢性炎症が惹起され,さまざまな発がんにかかわっていることが報告されている.さらに肥満,糖尿病なども広義の慢性炎症として発がんに関与することが明らかにされてきている.また,遺伝子変異は無秩序な細胞増殖を引き起こすことでがん細胞をつくり出すことが広く受け入れられているが,加えて直接的に免疫系に影響を与えることが示されている.非小細胞肺癌のEGFR変異が,EGFR下流のJNK/cJUN経路の活性化によりがん細胞自身に制御性T細胞(Treg)誘導ケモカイン(CCL22)を産生させることで,腫瘍微小環境にTreg優位の免疫抑制環境を形成していることが明らかになっている9).また,胃癌で認められるRHOA変異は,IRF1発現に伴う脂肪酸合成に起因する代謝環境の変化によるTreg細胞優位の活性化を誘導して腫瘍微小環境にTreg優位の免疫抑制環境を形成していることが示された(第2章-7参照)10).つまり,「がん細胞がもつ遺伝子異常が免疫系に直接影響を与え,がん組織の免疫微小環境に影響を与えている」11)という全く新しい機序が存在しているといえる.これにより,遺伝子変異が蓄積されることによってがん細胞へ進展するとと同時に免疫系によるがんにとって有利な炎症反応が構築されていく,と考えられる.したがって,発がん過程では,がん細胞側の進化のみならず同時に起こる炎症,免疫系の進化も考慮することが重要である.われわれは本概念を免疫ゲノムがん進化説(immuno-genomic cancer evolution)としてまとめて発表した12).
以上より慢性炎症は,発がん過程で遺伝子変異を惹起してがん細胞の種を発生させるinitiation(初発)からはじまり,その後のpromotion(促進),progression(進展)に大きくかかわっている.事実,非ステロイド性抗炎症薬では,シクロオキシゲナーゼ2(COX-2)を過剰発現する大腸がんのリスクを優位に減少させることが示されている13).
2.炎症はがんを駆逐する(良い炎症)
免疫系は生体内に存在する自己と存在しない非自己を識別し,非自己を排除する機構であることをかんがみると,遺伝子変異の蓄積により発生するがん細胞は正常な細胞が本来持っていない遺伝子変異に由来するタンパク質(=非自己の物質:抗原)を有しているため,非自己と認識され攻撃,排除されると考えられる.生体内では絶えずこのような遺伝子変異を伴った異常細胞が出現するものの,免疫系により排除されることで生体は防御されている,という考えをPaul Ehrlichが20世紀初頭に提唱した14).この概念は,1960年代にMacfarlane BurnetとLewis Thomasにより「生体内では頻繁に細胞に遺伝子変異が発生して異常細胞(がん細胞)が出現するが,これらの危険ながん細胞は免疫系により認識され排除される」というがん免疫監視機構(cancer immunosurveillance)としてまとめられた15).免疫系が作動していることの証拠として,がん抗原の存在が重要である.この点については,純系マウスモデルを用いて,化学発がん剤により誘導された同系がん細胞株を移植されてそれらを拒絶したマウスは同じがん細胞株に抵抗性になるが,異なるがん細胞株は拒絶できないことを1943年にLudwik Grossが明らかにし,がん拒絶に特異性があることから,標的となる抗原(がん抗原)の存在が推測され,免疫系,とりわけCD8陽性T細胞の関与が示唆された16).
その後遺伝子改変技術などの実験技術の進歩により,種々の免疫関連遺伝子欠損動物等を用いて発がんへの影響が検討された結果,リンパ球が存在しないRAG(recombination-activating genes)欠損マウスやIFN(interferon)-γやパーフォリンといった抗腫瘍免疫応答にかかわる分子が欠損したマウスでは発がんが促進することが示され,免疫系による炎症が存在しないことが発がんを促進することが証明され,炎症により発がんが抑制されることが明確に示された17).さらに,近年T細胞の活性化を調節する免疫チェックポイント分子に対する阻害剤が臨床応用された.これらの免疫チェックポイント阻害剤の治療では,がん組織でPD-L1発現が高い場合やがん細胞がもつ遺伝子変異量(tumor mutation burden)が多い場合,つまりがん組織の微小環境が炎症型といわれるタイプのときに抗腫瘍活性が認められやすいことが明らかになっている18).このようにがん免疫療法という視点では炎症は抗腫瘍活性と直結しているといっても過言ではない.
おわりに─悪い炎症と良い炎症をどう見分けるか?
がんと炎症の関係を考えるうえでは,前述の2つの相反する効果をもたらす炎症を見分ける必要がある.例えば肝炎ウイルスに着目するとA型肝炎は急性肝炎で治癒に向かい,発がんに至ることは稀である.一方でB型やC型肝炎は慢性化して発がんにかかわることが知られている.この点からは急性炎症(良い炎症)vs慢性炎症(悪い炎症)という考え方も想起される.しかし,急性炎症がくり返される場合も慢性炎症と同様に発がんのリスクは高まるとともに,免疫チェックポイント阻害剤によるがん治療では長期に治療効果が認められることから,必ずしも急性炎症のみが重要である,とは言い難い.
したがって良い炎症,悪い炎症は明確に区別できるものではなく,生体のその時点での状態,環境因子にも大きく影響を受けると考えられる.外的および内的要因による侵襲によってもたらされた炎症はがん細胞の種を発生させる(initiation).しかし多くの場合はこれらの細胞がもつ遺伝子異常を非自己と認識して免疫応答が誘導され,これらの細胞は排除され,組織が再生され正常な組織へと回復する.しかし,これらをくり返すうちにさまざまな原因によって十分な免疫応答が誘導されなくなる.その原因の一つはがん細胞がもつ遺伝子異常が構築する免疫抑制機構であり,そうなると本来は免疫原となって免疫応答が誘導されることから存在できない遺伝子異常も存在可能となり,がん細胞側のpromotionからprogressionへの進化が起こり,発がんさらにはがんの進展へと至る(図).よって,このような免疫系とがん細胞のせめぎ合いの状況をゲノムだけでなく免疫系の変化をモニターすることで,どのような炎症が発がんに至るのか,また至らないのかということを明らかにし,真の「良い炎症」と「悪い炎症」を見分けることにつながると考えられる.さらにこのことが達成されれば,悪い炎症を早期に改善することで「発がんを防ぐ」もしくは「がんの進展を防ぐ」という予防や新たな治療への展開が可能になると考えられる.
文献
- Balkwill F & Mantovani A:Lancet, 357:539-545, doi:10.1016/S0140-6736(00)04046-0(2001)
- Wiemann B & Starnes CO:Pharmacol Ther, 64:529-564, doi:10.1016/0163-7258(94)90023-x(1994)
- 山極勝三郎,市川厚一:癌腫ノ人工的發生ニ就テ.癌,10:249-290,1916
- Rous P:J Exp Med, 13:397-411, doi:10.1084/jem.13.4.397(1911)
- Fearon ER & Vogelstein B:Cell, 61:759-767, doi:10.1016/0092-8674(90)90186-i(1990)
- Hanahan D & Weinberg RA:Cell, 100:57-70, doi:10.1016/s0092-8674(00)81683-9(2000)
- Hanahan D & Weinberg RA:Cell, 144:646-674, doi:10.1016/j.cell.2011.02.013(2011)
- Hanahan D:Cancer Discov, 12:31-46, doi:10.1158/2159-8290.CD-21-1059(2022)
- Sugiyama E, et al:Sci Immunol, 5:, doi:10.1126/sciimmunol.aav3937(2020)
- Kumagai S, et al:Immunity, 53:187-203.e8, doi:10.1016/j.immuni.2020.06.016(2020)
- Kumagai S, et al:Nat Rev Cancer, 21:181-197, doi:10.1038/s41568-020-00322-0(2021)
- Kumagai S, et al:Nat Rev Clin Oncol, doi:10.1038/s41571-024-00870-6(2024)
- Thun MJ, et al:N Engl J Med, 325:1593-1596, doi:10.1056/NEJM199112053252301(1991)
- Ehrlich P:Ned Tijdschr Geneeskd, 5:273–290, 1909
- Burnet FM:Lancet, 1:1171-1174, doi:10.1016/s0140-6736(67)92837-1(1967)
- Gross L:Cancer research, 3:326-333, 1943
- Rosenberg SA, et al:Nat Med, 10:909-915, doi:10.1038/nm1100(2004)
- Ribas A & Wolchok JD:Science, 359:1350-1355, doi:10.1126/science.aar4060(2018)
著者プロフィール
西川博嘉:1995年三重大学医学部医学科卒業.三重大学医学部附属病院等にて臨床研修の後,’98年三重大学大学院医学研究科博士課程内科学専攻入学.2002年同課程修了(医学博士).’03年Memorial Sloan Kettering Cancer Center リサーチフェロー,’06年三重大学大学院医学系研究科病態解明医学講座講師,’10年大阪大学免疫学フロンティア研究センター実験免疫学 特任准教授,’12年Roswell Park Cancer Institute, Adjunct Associate Professor(兼任)を経て,’15年より国立がん研究センター研究所腫瘍免疫研究分野 分野長/同センター先端医療開発センター免疫トランスレーショナルリサーチ(TR)分野 分野長,’16年より名古屋大学大学院医学系研究科微生物・免疫学講座分子細胞免疫学 教授をクロスアポイントメント.近年はがん組織の微小環境における免疫抑制ネットワークの本態解明とそれらを標的とした新規がん免疫療法の開発を行っている.’23年からはAMEDムーンショット型研究開発事業「慢性炎症の制御によるがん発症ゼロ社会の実現」のプログラムマネージャーをつとめ,慢性炎症とがんの関連の解明を進めている.