概 論
免疫細胞サブセット概論
―止むことなく出現する新規サブセット
上野英樹
(京都大学大学院医学研究科免疫細胞生物学/
京都大学高等研究院ヒト生物学高等研究拠点ASHBi/
京都大学免疫モニタリングセンターKIC)
さあ,複雑な免疫系をどこまで単純化して理解できるのか,2024年の現状を一緒に見てみよう.
[略語]
- CD4 CTL細胞:
- CD4+ cytotoxic T lymphocytes(CD4+細胞傷害性T細胞)
- MAIT細胞:
- mucosal-associated invariant T cells
- mregDC:
- mature DCs enriched in immunoregulatory molecules
- Tfh細胞:
- T follicular helper cells(濾胞性ヘルパーT細胞)
- Tph細胞:
- T peripheral helper cells(末梢性ヘルパーT細胞)
- Treg細胞:
- regulatory T cells(制御性T細胞)
- TRM細胞:
- tissue resident memory T cells(組織常在型記憶T細胞)
はじめに
免疫系は自然免疫系と獲得免疫系で構成される(図1).自然免疫系は病原体の侵入を感知し病原体の排除に向けたさまざまな免疫応答を開始する.抗原提示細胞である樹状細胞も病原体の侵入を感知し,他の自然免疫系細胞やバリア機能に関与する非免疫細胞から得られる情報を統合し,これらの情報を獲得免疫系に伝達する.獲得免疫系は病原体の発現するタンパク質などの抗原に対する特異的な免疫応答を構築する.ここでは,樹状細胞や二次リンパ組織内からの情報をもとに,病原体の種類に適したタイプのT細胞,B細胞応答が誘導される.これらの細胞による抗体産生,感染細胞の傷害,サイトカインによる感染組織炎症などを介して病原体の排除を行う.一部の獲得免疫系細胞は記憶細胞となり,2度目以降の病原体曝露の際にすみやかに生体防御機構を発揮する.
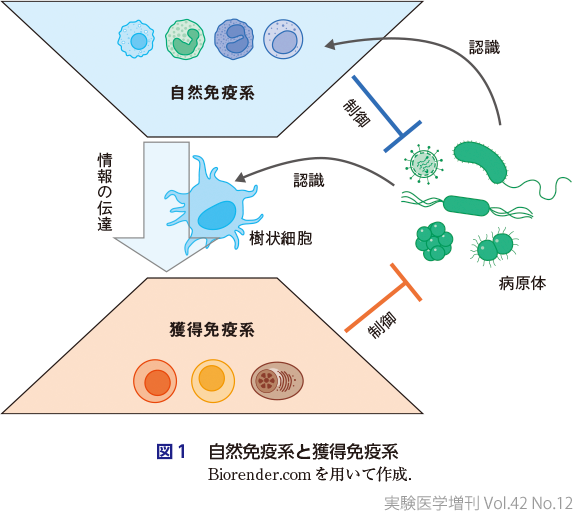
これは教科書的な表現であり,筆者も医学部の学生の免疫の授業で教える内容である.しかし,実際にヒト体内で日々実際に起こる免疫応答は,この教科書的な内容よりかなり複雑であることは間違いない.しかも,免疫研究手法の進化に伴い,さまざまな現象が細胞サブセット,分子レベルでより詳細に明らかにされ,教科書的な内容ですら書き換えが必要になることも少なくない.例えば,抗体反応誘導にかかわるCD4+ ヘルパーT細胞はほんの10年ほど前まで(現在でも完全に消滅はしていないが)Th2細胞と広く考えられていたが,現在は濾胞性ヘルパーT細胞(Tfh細胞)が最も重要なサブセットであることが確立されている.
本稿では,本増刊号の概論として,どのような免疫の概念,免疫細胞サブセットが新しいのかを紹介し,免疫細胞サブセットの多様性やヒトとマウスでの免疫研究について触れる.さらに大枠での免疫細胞の種類を紹介し,増刊号で触れる内容を簡単に紹介する.
1.日々増加する免疫細胞サブセット
最近明らかになった,「教科書的な内容でない」免疫機構,免疫細胞とは一体どのようなものだろうか.そもそも,なぜこういった細胞が見つかったのだろうか?
まず1点目として,近年の解析機器の進歩,解析手法の革新に伴い,免疫細胞の種類やそのサブセットの数自体が日々増加し続けていることがあげられる.以前は均一な細胞集団と考えられていた自然免疫系細胞ですらシングルセルレベルでは表現型や機能の異なるサブセットで構成されることもわかってきた.
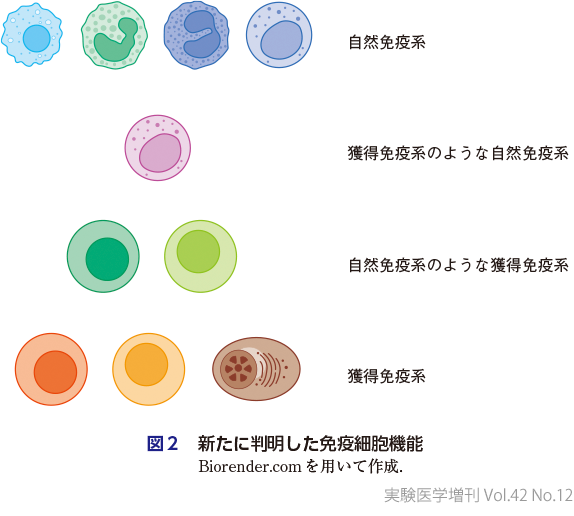
2点目として,NK細胞などの自然免疫系細胞も免疫記憶を形成することができ,獲得免疫系細胞のようにふるまうことができることがわかってきた(図2)1).逆にT細胞やB細胞などの獲得免疫系細胞がT細胞レセプターやB細胞レセプターからのシグナル,すなわち抗原による刺激非依存性にサイトカイン産生や炎症応答を誘導する,いわゆる自然免疫系細胞のような機能をもち多くの病態に関与することがわかってきた2)3).このうちT細胞についてはbystander T細胞活性化機能とよばれ,例えばヒトA型急性肝炎における肝障害の中心的な役割を果たすことが示されている4).またがん腫瘍領域では,がん抗原特異的T細胞よりも多くのウイルス抗原特異的なT細胞が集積し,一部が活性化することが知られている5).がん免疫におけるbystander T細胞の意義については今後の研究が待たれるところである.
3点目として,さまざまな組織に常在する免疫細胞は組織によって異なる表現型や機能をもつことが明らかになってきている.自然免疫系の細胞であるマクロファージやNK細胞なども異なるヒト臓器の局在によって異なる表現型,機能をもつ.
4点目として,以前から自然免疫系リンパ球として知られていたMAIT細胞やNKT細胞もヒトにおける新たなリガンドの発見や多彩な免疫応答,免疫記憶の構築など,その機能の多様性が明らかになってきている.今回は取り上げなかったがγδT細胞も今後そのリガンドや多様性がより明らかになってくるかもしれない.
2.ヒト免疫学とマウス免疫学
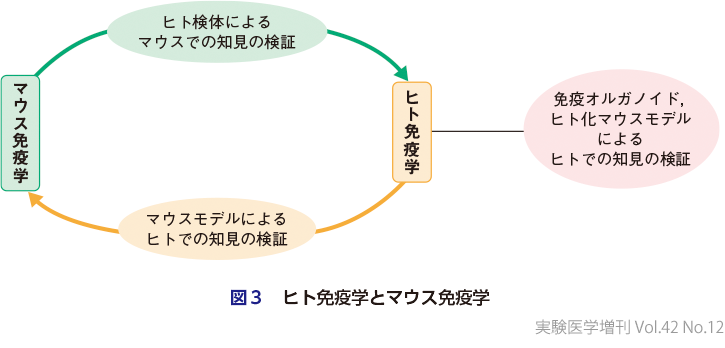
ヒトとマウスでは,免疫細胞サブセットの分化機構,表現型,機能など,多くの点で異なる6)7).ヒトとマウスの進化の分岐は約9,600万年前に起こり,長い時間をかけて生態系に適する形でそれぞれ進化した.マウスとヒトは寿命も異なるし,もちろん住環境,食物も大きく異なる.常在菌叢も異なれば,生涯にかかる感染症の種類も回数も異なる.ゲノム情報の違いに加えて,これらエピゲノムでの差異があるため,ヒトとマウスの免疫細胞での知見に違いが生じるのは不思議ではないと考えている.
免疫学の究極の目的が「ヒトにおける免疫応答制御機構の理解と疾患病態の理解」,それにもとづいた「ヒト人生の質と長さの改善」にあるとすると,ヒト免疫細胞の理解は必要不可欠なものである.これが「ヒト免疫学」が必須である理由である.一方で,免疫細胞の生物学的特徴の詳細な解析,分化にかかわる分子機構の解明には,マウスモデルでの研究,すなわち「マウス免疫学」も必須である.したがって,マウスとヒトでの免疫応答に違いがあることは認識しつつ,ヒト免疫学とマウス免疫学の両者での知見を統合して免疫系を理解していくことが重要と考えている.独自の研究手法の進化に伴い,「ヒト免疫学」と「マウス免疫学」は別の学問としてそれぞれ発展し続けると予想する(図3).融合できる現象,すなわち種を超えて保存されている機構に関しては,統合による解析でより明確なエビデンスの創出をめざす,という方向に免疫学研究分野が進化していくのではないだろうか.また今後は免疫オルガノイド8)9)やヒト化マウスモデル10)を用いたヒトでの知見の検証が進むであろう.この分野の発展は前臨床試験のあり方自体を変えていくかもしれないと考えている.
3.本増刊号の構成
序に述べたように,本増刊号は2024年現時点での最新の免疫細胞サブセットを理解することを目的としている.ヒト検体を用いて発見されたヒト免疫細胞やそのサブセットの新たな知見のみならず,画期的なマウスモデルを用いた免疫細胞やそのサブセットの新たな知見の両者を含んでいる.第1章 自然免疫系,第2章 獲得免疫系,第3章 Innate-likeリンパ球,第4章 免疫細胞の疾患とのかかわり,の4章構成とした(図4).
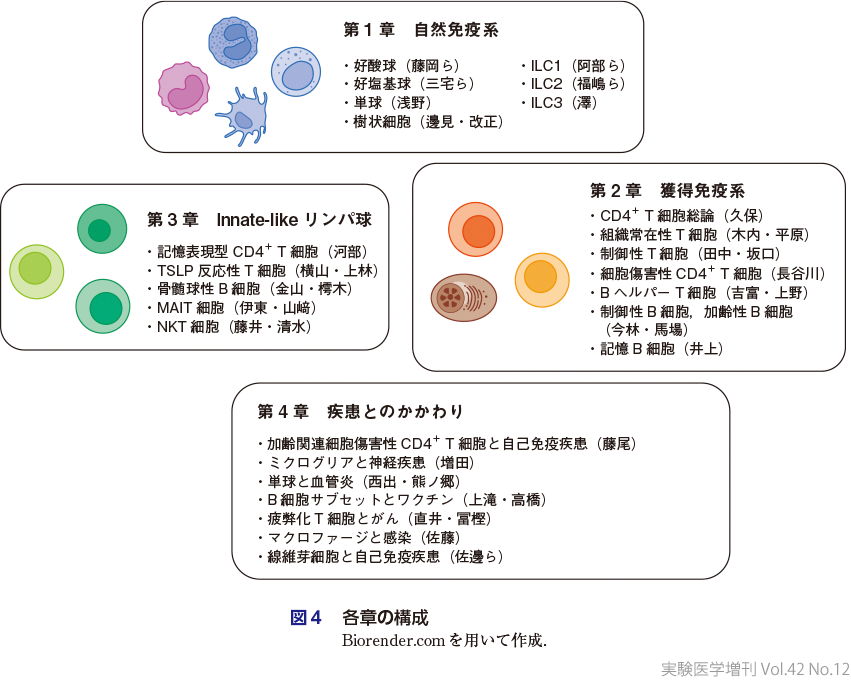
1)第1章 自然免疫系
自然免疫系は感染に対するフロントラインを構成する細胞であり,病原体や組織障害から私たちの体を守る役割を果たしている.バリア機能を果たす上皮細胞の他,組織を見張り続けるマクロファージ,樹状細胞,血液中の顆粒球,単球,自然免疫系リンパ球などが含まれる.本号では,顆粒球系の細胞からは好酸球(第1章-1,藤岡ら),好塩基球(第1章-2,三宅ら)を取り上げた.好酸球は顆粒内にRNaseを大量に含むためにシングルセル遺伝子解析は困難であったが,解析手法の進化により好酸球にサブセットが存在することが示された.これは好酸球のターンオーバーが数日〜数週と短いことを考慮すると驚くべきことである.また,好塩基球は血中循環型のマスト細胞であると長らく考えられてきたが,生体内で好塩基球がマスト細胞と異なる機能を果たしていることが認識されつつある.好塩基球やマスト細胞はIgE受容体架橋による脱顆粒のみならず,生体内でのIL-4,IL-13産生細胞としても多くのアレルギー疾患に関わっている.
組織や血液で見張り役を司る分画からは単球(第1章-3,浅野),樹状細胞(第1章-4,邊見・改正)を取り上げた.単球はヒト末梢血ではCD14とCD16のマーカーを用いて3つのサブセットに分類することが主流であるが,全身性の炎症などによって誘導される好中球様単球とよばれるサブセットが他に存在する.好中球様単球は好中球系の前駆細胞から誘導され,浅野らはマウスではIL-10などのサイトカイン産生を介して自己保護作用を担うことを示している.樹状細胞は自然免疫系と獲得免疫系をつなぐ,重要な抗原提示細胞であるが,この細胞も複数の機能の異なるサブセットで構成される.最近ではヒト末梢血でのシングルセル遺伝子解析により,DC3とよばれる新たな樹状細胞サブセットが発見されている11).DC3は組織炎症に伴って誘導されると考えられるが,がん組織において新たに見つかったmregDCという新たなサブセットとの類似点もあり12),その発生,機能,多様性につき今後の研究が待たれる.
自然免疫系リンパ球からNK,ILC1細胞(第1章-5,阿部ら),ILC2細胞(第1章-6,福嶋ら),ILC3細胞(第1章-7,澤)の内容を含めた.ILC1,ILC2,ILC3細胞はそれぞれ獲得免疫系CD4+ T細胞のTh1,Th2,Th17細胞の自然免疫系のカウンターパートとして機能している.ILC細胞はT細胞レセプターなどの多様な抗原を認識する機構をもたず,環境因子に応答して異なるサイトカインを産生する.ILC1細胞とNK細胞はIFN-γ産生や細胞傷害活性など機能の類似した細胞でありながら,分化経路(controversialではある)や生体内での局在が異なる.阿部・生田らはマウスILC1が胎仔肝臓と生体骨髄から生じ,機能や表現型の異なる細胞集団へと分化することを見出しており,ILC1内にも多様性が存在することを示している.ILC2はIL-25やIL-33,TSLPといった組織由来のサイトカインに反応してIL-4,IL-5,IL-13,GM-CSFなどの2型サイトカインを大量に産生し,多くのアレルギー疾患に関与する.ヒトILC2も体内での局在,炎症の程度によって異なる表現型,サイトカイン応答を持ち,可塑性に富む細胞であると考えられる.ILC3細胞はTh17細胞と同様に転写因子RORγt依存性に分化するが,NK受容体発現が異なるサブセットの存在に加えて抗原提示細胞機能をもつ分画の存在,ILC1細胞への可塑性が報告されており,ILC2細胞と同様に生体内では多彩な細胞集団として機能していると考えられる.ヒト疾患においてILC細胞が独自の機構により単独で病態に関与するか,あるいはCD4+ T細胞と共通した機構で関与しているのか,今後の研究展開が楽しみである.
2)第2章 獲得免疫系
獲得免疫系は抗原特異的な免疫応答を司るT細胞とB細胞で構成される.B細胞は形質細胞へと分化し,抗原特異的な免疫グロブリンを産生する.本号ではT細胞について,CD4+ T細胞サブセットの総論をはじめとして(第2章-1,久保),組織常在性T細胞(TRM細胞)(第2章-2,木内・平原),制御性T細胞(第2章-3,田中・坂口),細胞傷害性CD4+ T細胞(第2章-4,長谷川),BヘルパーT細胞(第2章-5,吉富・上野)をカバーした.B細胞では制御性B細胞と加齢性B細胞(T-bet+ B細胞,ABCsなど名称はまだ一定しない)(第2章-6,今林・馬場)と記憶B細胞(第2章-7,井上)について触れている.
CD4+ T細胞はNaïve T細胞から分化する一群のエフェクター細胞と胸腺由来のFoxp3を発現する制御性T細胞(Treg細胞)に分けられる.エフェクター細胞では80年代後半にTh1細胞とTh2細胞が発見されて以降,数多くのサブセットが同定されてきた.詳細は久保による総論(第2章-1)をご参照いただきたいが,最近ヒトで発見され,その解析がさまざまな疾患で進んでいる末梢性ヘルパーT細胞など13)を含め,かなり研究が活発化している領域である.特に脾臓などのリンパ組織や血液を使ったT細胞の研究から,炎症部位や臓器に存在するT細胞の解析へと研究対象がシフトするにつれ,組織間でのT細胞の違いが広く認識されるようになった.
細胞傷害性CD4+ T細胞(CD4 CTL細胞)はウイルス感染によって誘導されることが知られている.CD8+ T細胞と同様にウイルス感染細胞に対する排除機構を担っていると考えられているが,超百寿者(スーパーセンテナリアン)の血液中でCD4 CTL細胞の頻度が高いことが知られていた14).長谷川らはヒトの皮膚組織においてサイトメガロウイルス特異的なCD4 CTL細胞がHLA-Ⅱ依存的に老化線維芽細胞を監視,除去するという画期的な現象を見出している15).これは免疫細胞が老化予防に直接的に関与するエビデンスの1つであり,今後老化機構を停止,あるいは逆行させるような治療を開発するうえで大きな切り口になると考えられる.
CD4+ T細胞のうち,B細胞と会合することで抗体産生や高親和性B細胞の選択にかかわる細胞をBヘルパーT細胞とよぶが,この細胞群にはリンパ組織内の胚中心に存在する濾胞性ヘルパーT細胞(Tfh細胞)と,末梢組織内の三次リンパ組織とよばれる部位に存在する末梢性ヘルパーT細胞(Tph細胞)が存在する.Tfh細胞とTph細胞は多くの点で共通した特徴を持つが,その存在局所が異なることにより異なるB細胞応答制御を行っていると考えられる.さまざまな疾患でTfh,Tph系に属する細胞が見出されており,今後これらの細胞の疾患での功罪,その機構が明らかにされることが期待される.
制御性T細胞(Treg細胞)はCD25を発現する胸腺由来の免疫制御機構をもつT細胞として坂口らにより1995年に世界ではじめて報告された16).Treg細胞は多様な組織における免疫応答を効果的に抑制するために,炎症タイプや正常・疾患組織の特異的な環境に適応して機能を発揮する.この可塑性という点,メカニズムにおいてTreg細胞とエフェクターT細胞の共通点が多く,両細胞が組織微小環境に適応するうえで非常に重要なファクターとなっている.臓器に常在する非Treg細胞は組織常在性T細胞(TRM細胞)とよばれ,最近10年でかなり研究が進んだ領域である.マウスにおいては,CD8+ TRM細胞の分化に重要な転写因子としてHobitとBlimp-1が同定されている17).CD4 TRM細胞やヒトでのTRM細胞の分化機構の解明が待たれるところである.
B細胞は抗体産生細胞である形質細胞へと分化する他,抗原提示細胞としても作用する.他にも免疫応答の促進や制御にさまざまな形で関与する.液性免疫記憶を司るのは体内に長期生存する記憶B細胞と形質細胞である.記憶B細胞あるいは形質細胞へと分化する運命を決定づける機構が何なのか,長年謎であったが,マウスではB細胞レセプターの親和性が低い細胞が記憶B細胞へと分化しやすいことが示されている18).また記憶B細胞へと分化する細胞は抗体フィードバック制御とよばれる機構によってもそのレパトアが選択されることがわかってきている.これは体内に存在する抗体が抗原に結合することによってこれらの部位がマスクされ,結合部位以外の抗原部位を認識するB細胞が選択的に増殖する機構である19).加齢性B細胞も記憶B細胞の一種と考えられるが,ヒトでは典型的な記憶B細胞のマーカーであるCD27を発現しない.近年このB細胞が自己免疫疾患で増加すること,濾胞外経路によりTph細胞などからのシグナルを受けて自己抗体を産生する形質細胞に分化することが明らかになってきた.最近マウスでのこの細胞分化に転写因子Zeb2の関与が示され20),ヒトとの関連を含め今後の展開が楽しみである.
3)第3章 Innate-likeリンパ球
この章では,獲得免疫系のT細胞やB細胞であるにもかかわらず,自然免疫系細胞のようにふるまうInnate-likeリンパ球について触れる.Innate-like T細胞には,非常に限定された,あるいは同一のT細胞レセプターを発現し,MHC非依存性な経路できわめて限局的なリガンドを認識するMAIT細胞(第3章-4,伊東・山﨑)やNKT細胞(第3章-5,藤井・清水)が存在する.MAIT細胞は非古典的MHC分子であるMR1に結合する,細菌抗原5-OP-RUがリガンドとして知られていたが,伊東・山﨑らは硫酸化胆汁酸CA7Sが自己由来リガンドとして機能することを見出している21).興味深いことに,ヒトMAIT細胞が細菌抗原と自己抗原で異なるMAIT細胞応答を誘導することが示された.一方でNKT細胞には,通常のCD4+ T細胞と同様にNKT1,NKT2,NKT17細胞サブセットや免疫記憶機構が備わっていることがわかってきている.NKT細胞は肺,肝臓,脾臓など特定の臓器に豊富に存在しており,ILC細胞やMAIT細胞と一部重複した機能を果たしているのかもしれない.
MAIT細胞やNKT細胞は自然免疫系リンパ球のようにサイトカイン刺激に反応して活性化する.同様に,通常の多様なT細胞レセプターを発現するT細胞でも組織の微小環境や,サイトカイン刺激によって抗原非依存性に活性化される機構が存在する.この現象のなかには,マウスにおいてTSLPに反応してT細胞がIL-13を産生し,皮脂腺を刺激して皮脂の生成を亢進させることでマウスの体重減少,脂肪減少をもたらすという興味深い現象が含まれる(第3章-2,横山・上林).さらにマウスにおいて,Naïve CD4+ T細胞がT細胞レセプターからの刺激を受けることなく,すなわち通常のプライミングのステップを経ずにメモリー表現型CD4+ T細胞へと分化する現象が観察されている(第3章-1,河部).これらのT細胞もサイトカイン刺激に対して活性化することが示されている.
さらに,Innate-like B細胞として骨髄球性B細胞を紹介する(第3章-3,金山・樗木).これは,マウスにおいて,全身的な感染症やLPS投与後に誘導される緊急時ミエロイド系細胞産生に伴って分化するCD11b+のB細胞である.骨髄球性B細胞はIL-10発現を介して敗血症性ショックに伴う細胞死から造血前駆細胞を保護し,緊急時ミエロイド系細胞産生を促進する.B細胞が抗体産生や抗原提示細胞の機能以外に,サイトカイン産生を介して免疫応答に関与するInnate-likeリンパ球としての機能の一例と考えられる.
4)第4章 免疫細胞の疾患とのかかわり
この章では新しく見つかった免疫細胞サブセットとそれらの疾患での機能について紹介する.
自己免疫疾患では,新規に発見された加齢関連細胞傷害性CD4+ T細胞と(第4章-1,藤尾)CD14+単球のサブセット(第4章-3,西出・熊ノ郷)を紹介する.藤尾らは加齢によって血中に増加するCXCR3弱陽性のage-associated helper T(ThA)細胞をヒトで発見した22).CD4 CTL細胞に似たプロファイルを示す一方でB細胞機能をヘルプする機能をもち,全身性エリテマトーデスにおいては自己抗体産生に関与すると考えられている.西出・熊ノ郷らはANCA(anti-neutrophil cytoplasmic antibody:抗好中球細胞質抗体)関連血管炎において,シングルセル遺伝子解析によるCD14+単球の遺伝子発現パターンで臨床経過の異なる疾患での亜群が同定されたことを報告している23).
上滝・高橋(第4章-4)はワクチンで誘導されるヒトB細胞サブセットについて詳細に述べている.形質細胞や形質芽細胞に加えて,3つの異なる表現型をもった活性型B細胞が異なる事象で誘導されること,記憶B細胞が応答性の異なる細胞群を含むことなどを紹介している.がん微小環境で誘導される疲弊CD8+ T細胞(第4章-5,直井・冨樫)は抗PD-1などの免疫チェックポイント阻害によって活性化され抗がん作用を示すと考えられていたが,最近の研究で疲弊CD8+ T細胞に前駆型と終末分化型が存在し,免疫チェックポイント阻害に反応する分画は主に前駆型であることがわかってきた.さらに近年,がん組織ではCD4+ T細胞も疲弊化し,免疫チェックポイント阻害に反応する可能性も示唆されている.
組織に広く存在するマクロファージ(第4章-6,佐藤),線維芽細胞(第4章-7,佐邊ら)も臓器や疾患によってその性状,機能が大きく異なることがわかっている.ミクログリアは中枢神経実質に存在するマクロファージであるが,近年のシングルセル遺伝子解析によりさらに機能の大きく異なるサブセットで構成されることが明らかとなった(第4章-2,増田).ミクログリアは炎症誘導性にも神経保護性にも変化しうる多彩な可塑性をもち,今後のさまざまな脳神経疾患に対する新規治療法でのターゲットとなりうる.佐藤らはSARS-CoV-2急性感染で産生されるIL-10依存性に誘導されるM2c-type肺胞マクロファージがACE2発現を増強し,SARS-CoV-2感染を起こすことを見出している24).さらに,佐邊・石井らは,関節リウマチの炎症性滑膜に存在する線維芽細胞は炎症誘導性サブセット,骨軟骨破壊性サブセットと,骨軟骨修復,再生サブセットなど,全く機能の異なる分画で構成されることを示している.
おわりに
日常的に行われるようになったシングルセルレベルの解析により,多くの免疫細胞サブセットが発見されてきた.今後は,自由に解析できる公共データベースがますます充実することは間違いない.そうなると,研究者は既存のデータベースでカバーされない情報をさらに得ようと動くだろう.症例を厳格に選んだり,組織やシングルセル解析を行う組織内での領域を厳密に定義したりするようになるだろう.また希少疾患での解析もどんどん行われるようになるだろう.すなわち,今後もデータベースは拡大する一方であり,新たな免疫細胞サブセットの発見は加速する一方であろうと考えられる.
筆者の研究室では数年前からヒト肝臓組織を用いたヒト肝臓免疫研究を展開している.シングルセルレベルでの解析で見えてくる景色は,まるで深海にもぐって新たな生物を発見しているかのように錯覚することがある.ヒト免疫研究はいま,非常にエキサイティングな時代に突入したと感じている.新しいヒト免疫細胞サブセットを見つけるため,老化を理解するため,病気を理解するため,治療薬を開発するため,動機は何でもいい.1人でも多くの学生や研究者がヒト免疫学の面白さに気づいて,この分野に参加してくれることを祈るばかりである.
皆さん,一緒にヒト免疫学をはじめませんか?
文献
- Cerwenka A & Lanier LL:Nat Rev Immunol, 16:112-123, doi:10.1038/nri.2015.9(2016)
- Meier SL, et al:Nat Cancer, 3:143-155, doi:10.1038/s43018-022-00335-8(2022)
- Maurice NJ, et al:J Immunol, 206:455-462, doi:10.4049/jimmunol.2000937(2021)
- Kim J, et al:Immunity, 48:161-173.e5, doi:10.1016/j.immuni.2017.11.025(2018)
- Simoni Y, et al:Nature, 557:575-579, doi:10.1038/s41586-018-0130-2(2018)
- 「特集:夜明けを迎えたヒト免疫学」(上野英樹/企画),実験医学 Vol.40 No.1(2022年1月号),羊土社(2022)
- Pulendran B & Davis MM:Science, 369:eaay4014, doi:10.1126/science.aay4014(2020)
- Wagar LE:Nat Rev Immunol, 23:699, doi:10.1038/s41577-023-00956-9(2023)
- Wagar LE, et al:Nat Med, 27:125-135, doi:10.1038/s41591-020-01145-0(2021)
- Chuprin J, et al:Nat Rev Clin Oncol, 20:192-206, doi:10.1038/s41571-022-00721-2(2023)
- Villani AC, et al:Science, 356:eaah4573, doi:10.1126/science.aah4573(2017)
- Ginhoux F, et al:Nat Rev Immunol, 22:67-68, doi:10.1038/s41577-022-00675-7(2022)
- Rao DA, et al:Nature, 542:110-114, doi:10.1038/nature20810(2017)
- Hashimoto K, et al:Proc Natl Acad Sci U S A, 116:24242-24251, doi:10.1073/pnas.1907883116(2019)
- Hasegawa T, et al:Cell, 186:1417-1431.e20, doi:10.1016/j.cell.2023.02.033(2023)
- Sakaguchi S, et al:J Immunol, 155:1151-1164, doi:undefined(1995)
- Mackay LK, et al:Science, 352:459-463, doi:10.1126/science.aad2035(2016)
- Shinnakasu R, et al:Nat Immunol, 17:861-869, doi:10.1038/ni.3460(2016)
- Schaefer-Babajew D, et al:Nature, 613:735-742, doi:10.1038/s41586-022-05609-w(2023)
- Dai D, et al:Science, 383:413-421, doi:10.1126/science.adf8531(2024)
- Ito E, et al:Sci Immunol, 9:eade6924, doi:10.1126/sciimmunol.ade6924(2024)
- Goto M, et al:Sci Immunol, 9:eadk1643, doi:10.1126/sciimmunol.adk1643(2024)
- Nishide M, et al:Nat Commun, 14:5789, doi:10.1038/s41467-023-41328-0(2023)
- Mitsui Y, et al:Immunity, 56:1939-1954.e12, doi:10.1016/j.immuni.2023.06.013(2023)
著者プロフィール
上野英樹:1992年京都大学医学部卒業,小児科に入局.2000年博士号取得後,’01年より米国テキサス州ダラスのベイラー免疫研究所にてポスドク,’04年より主任研究員となる.’16年米国ニューヨーク州マウントサイナイ医科大学,微生物学教室教授.’19年7月,京都大学大学院医学研究科 免疫細胞生物学 教授に,クロスアポイントメントで着任.’21年4月より京都大学専属となる.研究の専門はヒト免疫学.ヒト検体を用いたヒト基礎免疫,臨床免疫学を行っている.昭和なものが好きで,日本製オーディオをいじるのが趣味.




