概 論
RNA研究の新たな地平:ノンコーディングRNA研究からマテリアルとしてのRNA研究へ
中川真一
(北海道大学薬学研究院)
[略語]
- arcRNA:
- architectural RNA
- miRNA:
- microRNA(マイクロRNA)
- ncRNA:
- non-coding RNA(ノンコーディングRNA)
- piRNA:
- PIWI-interacting RNA
- T2T:
- telomere to telomere
1.近年のノンコーディングRNA研究の動向
いま,ノンコーディングRNA(ncRNA)研究が再び熱を帯びてきている.ノンコーディングRNAの研究というよりも,RNA研究全体が大きな熱を帯びた転換期を迎えつつある,と言ったほうがよいかもしれない.一般に,遺伝子を中心とした分子生物学の研究は,「見つける」,「知る」,「使う」,の3つの段階を踏みながら発展していくものであるが,ncRNA研究界隈では,過去5年ほどの間に,そのすべてのステップにおいて大きな出来事があった(図1).
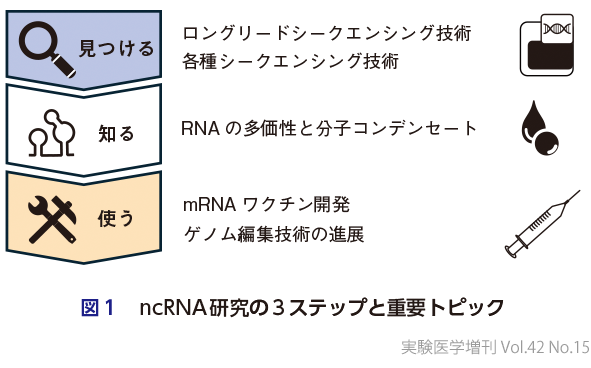
1)ncRNAを「見つける」
「見つける」に関して大きな貢献を果たしたのが,1分子シークエンシング技術・ロングリードシークエンシング技術の爆発的な発展である.これまで不可能であったリピート配列の解析が可能となり,2022年に発表されたT2Tゲノム(テロメアからテロメアまでの染色体丸ごとの完全長シークエンス)の決定は大きなニュースとなった1).リピート配列から転写されるRNAは基本的に多価(multivalent)であり,後ほど述べるように,多価性(multivalency)は,RNAが機能を発揮するメカニズムを考えるうえで,非常に重要な概念となる.実際,リピート配列から転写される機能性の新規ncRNAが近年次々と報告されており2),T2Tゲノムの完成により,それらリピート配列由来のncRNAを網羅的に捉え,包括的な研究を進める環境が初めて整った意義は大きい.また,1分子シークエンシング技術・ロングリードシークエンシング技術は,長い配列を読むだけが能なのではない.RNAという分子を,「情報」でなく「物質(マテリアル)」として取り扱うことができるというところに,従来のサンガー法では決してなし得なかった技術的な凄さがある.そして,ncRNA研究の本質とは,情報としてのRNA機能ではなく物質としてのRNA機能を探求するところにあり,そういった意味で,この技術がncRNA研究に与える影響の大きさは自ずと理解できるところであろう.この技術によって,間接的にしか調べることができなかったRNAの塩基修飾を,かつてないレベルで網羅的に,かつ詳細に調べることが可能になった3).RNA修飾を解析する技術は現在進行形で改良が続けられており,ncRNAの分子動作機構についても新たなコンセプトが生まれることが期待されている.
もう一点,「見つける」に関して忘れてはならないのが,リボソームプロファイリング技術の急速な普及である.リボソームプロファイリングとは,リボソームがまさにいま翻訳しているそのRNA領域をシークエンシングによって同定する技術であり,これにより,翻訳活性を塩基レベルで可視化することが可能になった(第1章-6参照).従来は一次配列の特徴を情報生物学的な観点から解析することでしかncRNAとmRNAを見分けるすべがなかったが,実験的にそれを検証することが可能となった.その結果,タンパク質をコードする能力をもたないと見なされていた細胞質ncRNAの多くが,実はmRNAとして機能している,という事実が明らかとなりつつある4).この発見によってncRNAによる生体制御機構の新たな水平線が見えてきたわけではないが,ncRNA研究から出発して機能未知の新規生体高分子が大量に発見されたということの意義は大きいだろう.
2)ncRNAを「知る」
「知る」に関して近年大きなパラダイムシフトとなったのが,細胞内相分離に代表される,多価の弱い相互作用による分子コンデンセート(molecular condensates)形成の重要性の認識である5).細胞内には周囲を取り囲む脂質二重膜が存在しないにもかかわらず特定の分子プロセスにかかわる因子が集合した,いわゆる非膜オルガネラが存在している.非膜オルガネラの形成にかかわる因子の同定はこれまで着々と進められてきたが,それらがどのような原理で集合するのかということに関しては,驚くほど注意が払われてこなかった.それが,過去10年ほどの間に,非膜オルガネラのような柔軟な分子コンデンセートは多価の弱い相互作用が重要であること,そのような相互作用の多くは特定の構造を取りにくい天然変性領域(intrinsically disordered region)とよばれているドメインによって担われていること,その際,静電相互作用やπ-πスタッキングなどの相互作用が重要な役割を果たしていることなどが次々と明らかになってきた.ここで重要なのが,タンパク質のなかでも,RNA結合タンパク質は特に顕著な天然変性領域をもつものが多く,それらが本質的に柔軟な構造を取りやすいRNA分子と相互作用することで,柔軟な巨大分子集合体を形成することができる,という点である6).また,RNAはタンデムに並んだ相同配列を介して容易に多価性を生み出すことができるので,多価の弱い相互作用による分子コンデンセート形成のコアをつくるうえできわめて便利な分子である.実際,リピート配列由来の新規機能性ncRNAの発見に加え,既知のncRNAの機能解析においても,「同じ(機能をもつ)配列を複数もつ」ことが分子機能を発揮する際に本質的な役割を果たしているという例が次々と報告されているほか,RNA配列同士の相互作用が分子コンデンセート形成を誘導することができるという共通認識も形成されつつある7).「非膜オルガネラにはその構成成分としてRNA分子を含むものが多い」ことは古くから認識されていたが,その分子的基盤は,このRNAの多価性と,多くのRNA結合タンパク質がもつ天然変性領域の性質であったのだ.この理解のもと,NEAT1やXIST,あるいはNORADといった個別のncRNAの分子動作メカニズムについても,次々とその詳細が明らかにされつつある.
3)RNAを「使う」
「使う」に関して,mRNAワクチン技術の開発がncRNA研究にも強烈なインパクトを与えているのは論を俟たないところであろう.5′キャップ構造の発見,シュードウリジンの発見,ポリA配列の発見,mRNAワクチンの開発を可能にしたこれらの発見はすべて,分子生物学の黎明期に行われた,生命の神秘を分子の言葉で明らかにしたいというcuriosity-drivenの基礎研究の成果である.その後長い時を経て,それらの基礎研究の成果が人工合成mRNAを用いた遺伝子治療をめざす研究者たちのたゆまぬ努力によって医薬品の開発へとつながり,世界的なCOVID-19のパンデミックの克服に大きな貢献をしたのは記憶に新しい.
RNAという分子は「使える」分子である.この認識は広く研究者の間に共有され,ncRNA研究においても,「見つける」,「知る」の段階を経てその研究成果を医薬品の開発につなげようという大きなうねりが起きつつある.また,ここ数年でCRISPR-Cas9の利用に端を発したゲノム編集技術が広く普及したことも,RNA研究の基礎研究で得られた成果を応用へとつなげる動きを加速しているのは間違いない.そのCRISPRにしても,最初の報告は,全く関係のない遺伝子の下流にある奇妙なくり返し配列に関する記載であった.役に立たない発見などない.もし役に立たないとすれば,それは役立て方を知らないだけなのだ.RNA関連技術の爆発的な発展は,この事実を多くの研究者に気づかせてくれた.さらに重要なことに,RNAが関与するツールはCRISPRで打ち止めになったわけではない.ごく最近になって,ブリッジRNAを介して2つのDNA間の組換え反応を仲介する酵素が大腸菌の挿入配列因子から発見されており8)9),分子生物学の黎明期より使われてきたこのモデル生物がもつ分子ですらわれわれが完全に理解しているわけではない,ことは特筆に値しよう.
2.新たな時代を迎えるRNA研究
ここで改めてncRNA研究の歴史を振り返ってみると,遺伝学的な解析によって長鎖ncRNAであるXIST,roX,meiRNAやmiRNA遺伝子lin-4など,個別の機能性ncRNA遺伝子が報告されていた1990年代の第1フェーズ,miRNAをはじめとした小さなRNAの動作機構について大幅に理解が進むとともに,トランスクリプトーム解析によって大量の長鎖ncRNAが次々と発見された2000年代の第2フェーズ,小さなRNAだけでなく長鎖ncRNAについてもその具体的な動作メカニズムや生理機能が明らかとなってきた2010年代以降の第3フェーズに大きく区分することができるかと思う.前回,実験医学増刊号『ノンコーディングRNAテキストブック』が出版された2015年は,ちょうどこの第3フェーズが円熟期を迎えたタイミングであったが,最近のncRNA研究分野関連のエポックメイキングな出来事を見てみると,もはや「ncRNA研究」というカテゴリー分け自体があまり意味をなさないフェーズに入りつつあるようにも思われる.先に述べた通り,ncRNA研究の本質とは,RNAを情報として扱うのではなく,具体的な機能をもつ分子として捉えるところにあり,そういった意味では,tRNAやrRNAなどの研究や近年大流行のmRNAのエピトランスクリプトーム研究と,そのアプローチや方法論に大きな違いがあるわけではない.ポストゲノム時代に入った頃からか,miRNAやpiRNAに代表される小さなRNAと長鎖ncRNAに関する研究を特にncRNA研究として一括りにする傾向が続いてきたが,今後はそれぞれの研究が合流し,機能分子としてのRNAを見つけ,知り,そして使う,新たなRNA研究として発展を遂げてゆくのかもしれない(図2).
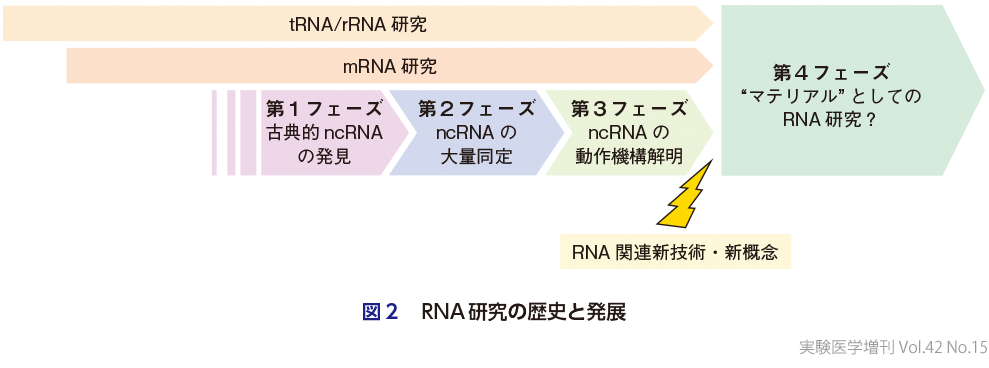
本書では,このRNA研究分野の大きな再編成を意識しながら,ncRNAを「見つける」,ncRNAを「知る」,ncRNAを「使う」,の各方面における最新の知見をまとめた.各論のなかには小さなRNAと長鎖ncRNAという狭義のncRNAの研究と密接な関連があるわけではないものも含まれるが,ncRNA研究の第4の波は,そういった研究分野も取り込んで発展してゆくことになるだろう.
1)新たな解析手法と見出された分子
第1章「ncRNAを“見つける”」では,新たなncRNAの姿を明らかにする最新の方法論や技術を取り上げる.第1章-1ではロングリードシークエンシング技術の登場によって可能になったT2Tゲノムの決定の意義とRNA研究における今後の展望について取り上げる.第1章-4ではRNAを物質として捉えることができるロングリードシークエンサーを用いてRNAの修飾を調べる最先端の技術について紹介する.また,ここ10年余りの間に,ショートリードのシークエンシング技術を応用して単なる発現解析以外の解析を可能とした技術が次々と出現し,ncRNA研究にも大きな影響を与えている.第1章-2では,特定の修飾状態をもつRNAポリメラーゼがつくり出す転写産物について見えてきた世界を,第1章-3ではRNAシークエンシングによってRNAの構造を解析する技術について,第1章-5では,難抽出性という生化学的な性質を利用して新しいカテゴリーのncRNAを同定する試みについて解説する.また,第1章-6では,リボソームプロファイリング技術を駆使して,従来はncRNAとして分類されていた転写産物が実は未知のペプチドをコードしているという近年の大きな発見について概説する.
2)見出される新たな機能・意義
第2章「ncRNAを“知る”」では,ncRNA研究をリードしてきた各種ncRNAについて,前回の増刊号が発行された2015年以降に得られた知識の主要なアップデートを取り上げる.第2章-1では長らくncRNAを牽引してきたmiRNA研究について,第2章-2ではここ数年著しく理解が進んだpiRNAによるクロマチン制御の分子機構について,第2章-8ではエピゲノム制御ncRNAのモデルシステムであり続けているXISTによる染色体不活性化について,第2章-9ではMALAT1をはじめとしたがん関連ncRNAについて取り上げる.また,ここ数年は,個別のncRNAについて,従来とは全く異なる新しいコンセプトが提出されたり,これまで手薄であった分子量論的な解析が行われたりするようになってきた期間でもあった.第2章-4ではarcRNAというncRNAのカテゴリを確立したNEAT1の研究によって明らかになってきた非膜オルガネラ形成の共通原理について,第2章-10では分子量論的解析によって明らかとなってきた,細胞質で機能するNORADや環状RNAなどのncRNAについて取り上げる.その他,かつてジャンクと扱われたリピート領域由来のRNAについて大きく理解が進んだものも複数あり,第2章-3では分子生物学の黎明期に発見されていながらその機能が長らく不明だったレトロトランスポゾン由来ncRNAの新機能について,第2章-5では同じく古くからその存在が知られていながら分子機能が不明だったHSATⅢの予想外の機能と分子動作機構について,第2章-11ではリボソーム遺伝子座から転写される多種多様な新規ncRNA群について,第2章-12では非モデル生物で見出されたさまざまなncRNAの機能について紹介する.さらに,近年,ncRNAと転写制御の役割,さらにはクロマチン構造へのかかわりが大きな注目を浴びているが,第2章-6ではELEANORを中心としたクロマチン制御について,第2章-7ではモデル実験によって明らかとなってきた転写制御とncRNAの役割について解説する.
3)RNAを使い細胞を操作する
第3章「RNAを“使う”」では,ncRNAに限らず,RNAを含む核酸分子の利用法について最新の話題を紹介する.第3章-1では翻訳を促進する活性をもつncRNAを利用したSINEUP技術について,第3章-2ではDNA/RNAアプタマーをはじめとした人工核酸の開発と利用について,第3章-3では,CRISPR-Cas9に続くバクテリア由来の新たなツールであるブリッジRNA依存性DNA組換え酵素について,第3章-4では合成生物学的なアプローチにおけるRNA分子の利用法について解説する.また,第3章-5ではRNAを標的とした低分子化合物の開発について,第3章-6ではアンチセンス核酸を利用したエキソンスキップ治療法について,第3章-7ではmRNAワクチンの開発で一躍脚光を浴びることになった修飾RNAを用いた遺伝子発現技術を取り上げ,RNA関連技術の医療応用について今後の展望を議論してゆく.
文献
- Nurk S, et al:Science, 376:44-53, doi:10.1126/science.abj6987(2022)
- Yap K, et al:Mol Cell, 72:525-540.e13, doi:10.1016/j.molcel.2018.08.041(2018)
- Leger A, et al:Nat Commun, 12:7198, doi:10.1038/s41467-021-27393-3(2021)
- Matsumoto A & Nakayama KI:Cell Struct Funct, 43:75-83, doi:10.1247/csf.18005(2018)
- Shin Y & Brangwynne CP:Science, 357:eauf4382, doi:10.1126/science.aaf4382(2017)
- Hirose T, et al:Nat Rev Mol Cell Biol, 24:288-304, doi:10.1038/s41580-022-00558-8(2023)
- Roden C & Gladfelter AS:Nat Rev Mol Cell Biol, 22:183-195, doi:10.1038/s41580-020-0264-6(2021)
- Durrant MG, et al:Nature, 630:984-993, doi:10.1038/s41586-024-07552-4(2024)
- Hiraizumi M, et al:Nature, 630:994-1002, doi:10.1038/s41586-024-07570-2(2024)
著者プロフィール
中川真一:1998年京都大学理学研究科生物物理学教室で学位取得.英国ケンブリッジ大学解剖学教室でポスドク後,京都大学生命科学研究科助手,理化学研究所発生再生科学総合研究センター研究員,理化学研究所独立主幹研究員,理化学研究所准主任研究員を経て2016年より北海道大学薬学研究院教授.配列から機能が予測できないノンコーディングRNAや天然変性タンパク質のマウス変異体を作り表現型を日々探しています.趣味は顕微鏡観察.








