概 論
マイクロバイオームの光と影
長谷耕二
(慶應義塾大学大学院薬学研究科生化学講座/ 福島大学食農学類附属発酵醸造研究所)
はじめに
常在微生物は私たちの身体の表面の至るところに存在しており,その集合体である微生物叢はマイクロバイオータ(microbiota)あるいはマイクロバイオーム※1(microbiome)とよばれている.従来の培養法と分子生物学的手法やバイオインフォマティクスが融合することで,マイクロバイオーム研究では近年目覚ましい成果が得られている.なかでも,腸内マイクロバイオームの異常とさまざまな全身性疾患の因果関係が明らかとなり,腸内マイクロバイオームの改善をめざした機能性食品や医薬品の開発も加速している.さらに,口腔,皮膚,呼吸器,泌尿器など腸管外のマイクロバイオームの性状解析を通じて,その生理的重要性や疾患とのかかわりを示す報告も相次いでおり1)〜4),マイクロバイオーム研究はまさに百花繚乱の様相を呈している.
1.マイクロバイオームのレゾンデートル
1)マイクロバイオームは質(組成)も量も大事
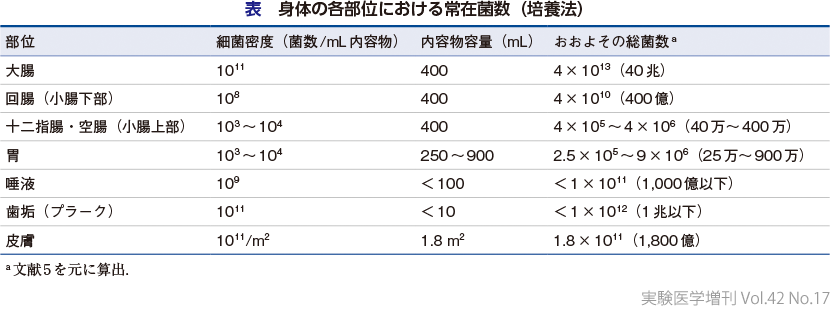
ヒト成人の腸管には生物六界のうち,植物界を除く五界が棲息するとされているが,なかでも圧倒的な存在量を誇るのは真正細菌(bacteria)である.その多くは大腸に棲息しており,その数は体重70 kgの成人男性で約38兆個であるとされている(表)5).これを重量に換算すると0.2 kg程度と見積もられる.ヒト体細胞の総数は約30兆個であるため,大腸には体細胞をやや上回る数の細菌が存在しているといえる.ただし,これは培養法による算出であり,フローサイトメトリーを用いたQMP(quantitative microbiome profiling)法で直接菌数を定量すると,健常成人40名のなかで約20〜120兆個もの範囲で大きく個人差があったことが報告されている6).また,炎症性腸疾患であるクローン病患者のQMP解析では健常者の1/3程度まで総菌数が減少していた.本知見は,マイクロバイオームと疾患の関連を調べる場合には,構成細菌の種類や多様性のみならず,総菌数も重要なファクターであることを示唆している.これは現在汎用されている16S rRNA遺伝子配列にもとづく菌叢解析だけでは見落としがちな視点であるため,筆者の研究室では菌叢解析を実施する際には,16S rRNA遺伝子共通プライマーを用いた定量PCRも同時に行うことで,できるだけ総菌数も定量するようにしている.
真正細菌以外にも腸内にはウイルス叢(virome)(第1章-7),真菌叢(mycobiome)(第1章-6),古細菌叢(archaeome)どが存在しており7),その実態や生物学的重要性が少しずつ明らかになりつつある.
2)隠れた臓器としての腸内マイクロバイオーム
なぜこれほど多くの細菌がわれわれの腸管に存在しているのであろうか? 腸内マイクロバイオームは,レジスタントスターチやレジスタントプロテイン,可溶性食物繊維など宿主が消化しきれなかった食物残渣を発酵分解し,短鎖脂肪酸(酢酸,プロピオン酸,酪酸)や補酵素(ビタミンB類やビタミンKなど)を宿主に提供している.生体で消費されるエネルギー源の約1割は腸内微生物発酵を介して供給されている事実から,腸内マイクロバイオームは「隠れた臓器」ともよばれる.このように,宿主の食物残渣を発酵分解する微生物叢は特にcommensal microorganisms※2と呼称される.マイクロバイオームは他にも,トリプトファン代謝物であるインドール系化合物,オルニチンに由来するポリアミン(プトレッシンおよびスペルミジン,第2章-6を参照),セロトニンやGABAに代表される神経伝達物質,二次胆汁酸など多種多様な代謝物を産生し,その一部は宿主−微生物間相互作用を支えるシグナル分子として機能する.これまでのマイクロバイオーム由来代謝物の研究は,水溶性代謝物に関するものがほとんどであったが,近年のリピドミクスの発達により,腸内細菌はHYAなど水酸化脂肪酸をはじめとする多様な脂質代謝物やレチノイン酸を産生することが明らかになりつつあり,その生理機能に注目が集まっている(第2章-3参照)8)9).
3)マイクロバイオームの多面的役割
宿主細胞は,特定のGタンパク質共役受容体(GPR40, 41, 43, 109a, 120など)や芳香族炭化水素受容体(AhR)を介して腸内代謝物を感知している.さらに,酪酸などはヒストン脱アセチル化酵素阻害作用を介してエピジェネティックに宿主細胞の分化や機能を変化させる.また,腸内細菌由来の代謝物が運動時のエネルギーとして供給される可能性が示唆されている(第2章-1).乳幼児期の腸内マイクロバイオームの定着は粘膜面の感染防御に重要であるのみならず,腸管免疫系や腸上皮バリアの構築に必要不可欠な役割を果たしている10).一方で,マイクロバイオームの定着は脳機能や脳神経系の発達にも重要である.無菌妊娠マウスや抗生物質を投与した妊娠マウスでは,胎仔脳の軸索形成が阻害されるが,これらの異常は母体マイクロバイオーム由来のいくつかの代謝物を投与することで予防できる11).加えて,母体マイクロバイオーム由来の短鎖脂肪酸はGPR41/FFAR3を介して,胎生後期における交感神経節やGLP-1産生性腸内分泌細胞の分化を促進することで,生後のメタボリックシンドロームに対する疾患リスクを下げることも判明している12).
以上を踏まえると,ヒトや齧歯類における腸内マイクロバイオームの
4)ユビキタスなマイクロバイオーム
腸管以外にも,口腔,皮膚,呼吸器,泌尿器(尿道や膣)など外環境に接した臓器には,ほぼすべからくマイクロバイオームが存在しており(表,第1章-Ⅰ),筆者はこれをユビキタス・マイクロバイオーム(ubiquitous microbiome)と呼称している.さらには,さまざまな腫瘍組織の内部や(第2章-13),議論が分かれるものの胎盤にもマイクロバイオームが見つかっている13).これら腸管外のマイクロバイオームの特徴や生物学的意義については各論を参照されたいが,私たちの身体はまさにユビキタス・マイクロバイオームと共生するSuperorganismであるといえる.
2.マイクロバイオームを標的とした医療は実現可能か?
1)マイクロバイオームのダークサイド
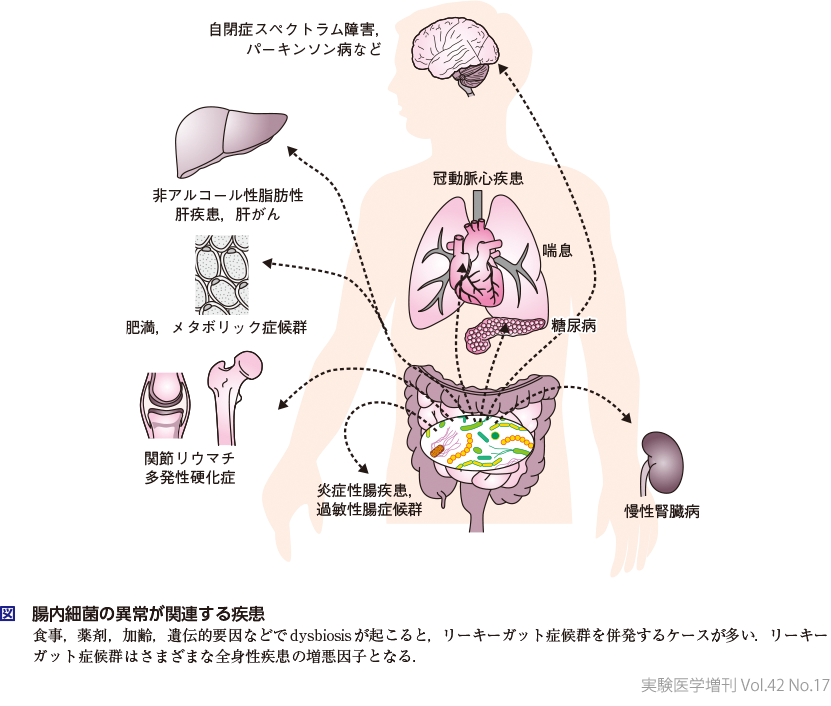
マイクロバイオームがさまざまな宿主機能を修飾していることを踏まえると,その変容が,潜在的に免疫系・代謝系・神経系における疾患のリスクファクターとなりうることは想像に難くない(図).食事様式(高脂肪食など),薬剤(抗菌剤やプロトンポンプ阻害剤など),加齢,生活様式(運動不足や睡眠不足など)によって,腸内マイクロバイオームのバランス異常が生じることをディスバイオーシス(dysbiosis)とよぶ.dysbiosisはしばしば,腸上皮バリアの低下を招き,リーキーガット症候群(leaky gut syndrome,LGS)とよばれる状態に至る.一概にはいえないものの,LGSにより腸内微生物,あるいはその成分や代謝物が腸管から全身に漏れ出すことが,全身性の炎症応答を招き種々の疾患の発症や増悪につながっているのかもしれない.実際に,dysbiosisが関連する疾患群とLGSが関連する疾患群には重複しているものが多い(図)14).dysbiosisによる疾患形成の詳細については第2章-Ⅲを参照されたい.
2)マイクロバイオーム創薬
マイクロバイオームが多様な疾患のリスクファクターとなりうることをふまえ,主に腸内マイクロバイオームを標的として,そのバランスの改善によって疾患治療につなげようとする「マイクロバイオーム創薬」の開発が進んでいる.その代表的モダリティの1つは糞便移植(fecal microbiota transplantation,FMT)である(第3章-2参照).FMTの最も古い記録は4世紀の中国に遡り,葛洪(Ge Hong)という中医が「黄湯」(yellow soup)と名付けた糞便発酵スープを食中毒や重度の下痢の患者の治療に用いたことが記されている15).近代医学の時代においては,1958年にアメリカの医師であるBen Eiseman らが,重度の偽膜性腸炎患者4名に対して健常者由来の便を用いたFMTを実施し,その有効性を報告するもあまり注目されなかった16).しかし,2013年にオランダの研究グループが難治性の再発性Clostridioides difficile感染症に対する無作為化比較対照試験(RCT)を実施し,治癒率80%以上という画期的な治療成績をあげたことで,FMTが一躍脚光を浴びるようになった17).現在では,炎症性腸疾患,GVHD(移植片対宿主病),過敏性腸症候群,メタボリックシンドローム,自閉症スペクトラム障害などさまざまな疾患を対象としてFMTのRCTが実施されている.
FMT以外にも,生菌製剤カクテル,低分子薬剤,ファージ療法,ファージ由来のエンドリシン療法,IgA抗体などさまざまなモダリティを用いたマイクロバイオーム創薬の開発が進行中である(第3章参照).
おわりに
哺乳類はマイクロバイオームの存在下で共進化してきており,それらが代謝,神経内分泌,免疫機能において重要な役割を担うようになっている.これは,宿主が健康な腸内細菌叢を利用して生物としての環境適応度を最大化していることを示唆している.一方で,腸内細菌群集の構成は,食事や薬剤などの環境要因によって大きく左右されるため,生活様式の現代化や抗生物質の使用による腸内の生物多様性の喪失は,ヒトの健康にリスクをもたらす可能性は否定できない.さらに環境変化を次世代に伝える役割をも担っているかもしれない.例えば,父親マウスに非吸収性の抗生物質を与えて,その腸内マイクロバイオームを撹乱すると,精子内で環境情報伝播を担うsmall RNA(miRNAやtRNAフラグメント)の発現が変化し,受精後の仔の胎盤発育不全を引き起こし,胎仔重量の低下や早期死亡リスクを高めることが報告されている18).また母体マイクロバイオーム由来の短鎖脂肪酸は胎児や胎盤の健全な発達に必須であり,その供給不足は低体重疾患や生後の疾患リスクの上昇につながる12)19).このようにマイクロバイオームは多臓器連関を担うのみならず,世代を超えた親子連関にもかかわっているといえる.
文献
- Baker JL, et al:Nat Rev Microbiol, 22:89-104, doi:10.1038/s41579-023-00963-6(2024)
- Enamorado M, et al:Cell, 186:607-620.e17, doi:10.1016/j.cell.2022.12.037(2023)
- Muraoka A, et al:Sci Transl Med, 15:eadd1531, doi:10.1126/scitranslmed.add1531(2023)
- Harris-Tryon TA & Grice EA:Science, 376:940-945, doi:10.1126/science.abo0693(2022)
- Sender R, et al:PLoS Biol, 14:e1002533, doi:10.1371/journal.pbio.1002533(2016)
- Vandeputte D, et al:Nature, 551:507-511, doi:10.1038/nature24460(2017)
- Geesink P & Ettema TJG:Nat Microbiol, 7:10-11, doi:10.1038/s41564-021-01031-6(2022)
- Tsugawa H, et al:Nat Aging, 4:709-726, doi:10.1038/s43587-024-00610-6(2024)
- Shiratori H, et al:Sci Rep, 13:8903, doi:10.1038/s41598-023-35097-5(2023)
- Al Nabhani Z, et al:Immunity, 50:1276-1288.e5, doi:10.1016/j.immuni.2019.02.014(2019)
- Vuong HE, et al:Nature, 586:281-286, doi:10.1038/s41586-020-2745-3(2020)
- Kimura I, et al:Science, 367:eaaw8429, doi:10.1126/science.aaw8429(2020)
- de Goffau MC, et al:Nature, 572:329-334, doi:10.1038/s41586-019-1451-5(2019)
- Kinashi Y & Hase K:Front Immunol, 12:673708, doi:10.3389/fimmu.2021.673708(2021)
- de Groot PF, et al:Gut Microbes, 8:253-267, doi:10.1080/19490976.2017.1293224(2017)
- Eiseman B, et al:Surgery, 44:854-859(1958)
- van Nood E, et al:N Engl J Med, 368:407-415, doi:10.1056/NEJMoa1205037(2013)
- Argaw-Denboba A, et al:Nature, 629:652-659, doi:10.1038/s41586-024-07336-w(2024)
- Pronovost GN, et al:Sci Adv, 9:eadk1887, doi:10.1126/sciadv.adk1887(2023)
<著者プロフィール>
長谷耕二:1994年富山医科薬科大学(現・富山大学)薬学研究科修士課程修了.山之内製薬株式会社を退職後,2000年よりカリフォルニア大学サンディエゴ校(UCSD)医学部ポスドクとして,ライフワークである腸上皮バリア学に関する研究に着手する.’04年より理化学研究所RCAI研究員,’12年より東京大学医科学研究所・特任教授を経て,’14年より現職.学生時代に『腸は考える』(岩波新書)に強く感銘を受けて以来,腸の研究に従事している.今後も「病は腸から」のメカニズムを明らかにしたい.



