第1章 細胞死とは
1 本書のねらいと構成
中野裕康
(東邦大学医学部医学科 生化学講座)
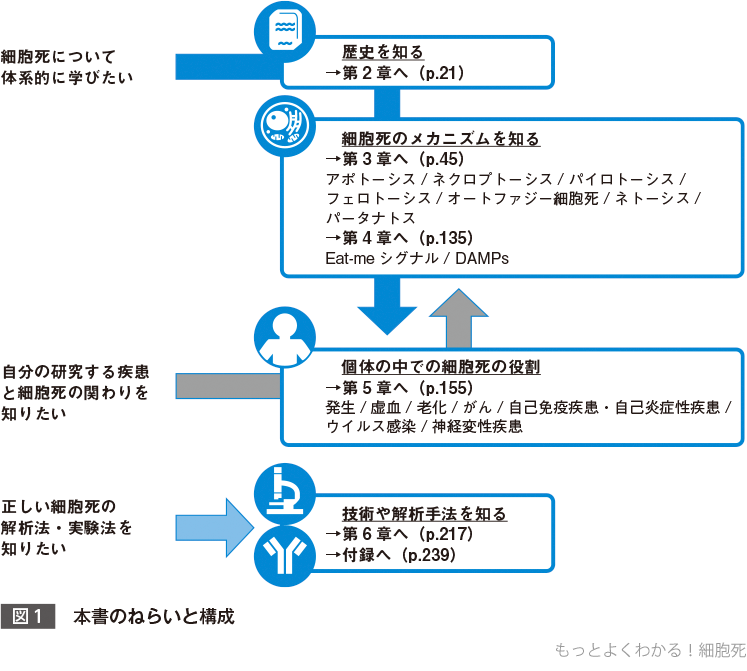
1細胞死研究の歴史〔第2章(p.21〜)〕
第2章では,アポトーシスと非アポトーシス細胞死の歴史について紹介している.アポトーシスは現在ではその分子メカニズムおよび形態学的な特徴から厳密に定義されているが,一方でアポトーシス以外の細胞死は,長い間ネクローシスとして総称され,かつ偶発的な(つまりわれわれの細胞のなかにある遺伝子により制御されていない)細胞死として記述されてきたという歴史がある.しかし,最新の研究から偶発的細胞死以外のネクローシスの存在が明らかとなり,それらは制御されたネクローシス(regulated necrosis)と呼ばれようになってきた.
アポトーシス研究の歴史は,1972年にKerrらが形態学的特徴をもとに「アポトーシス(apo:枯葉,ptosis:落ちる)」と命名したことにはじまる.その後,Horvitzらは線虫の変異体を用いた研究で,アポトーシスにかかわる遺伝子(cell death gene:ced)を次々とクローニングした.続いて,染色体転座によるリンパ腫の原因遺伝子の探索や,古典的なタンパク質精製法,expressed sequence tagデータベースのホモロジー検索,yeast two hybrid法,遺伝子発現ライブラリーを使った機能的発現スクリーニングなどのさまざまな手法を駆使して,各研究グループがアポトーシスのコアマシナリーに関与する遺伝子を次々と特定していった.
一方で非アポトーシス細胞死については,その存在は以前から知られていたものの,その分子メカニズムは不明であった.近年それらの実行に関与する遺伝子が次々と同定され,かつさまざまな疾患の病態に関与していること示された.このような背景から非アポトーシス細胞死研究は現在の細胞死研究の花形となっており,これらの細胞死に関与する実行因子が治療の標的となることが指摘されている.
2制御された細胞死の分子機構〔第3章(p.45〜)〕
第3章では,アポトーシスも含めたさまざまな制御された細胞死(regulated cell death)について,基本的な実行のメカニズムや,生体における生理的・病理的意義について記載している.
アポトーシス以外の細胞死としてネクロプトーシス,パイロトーシス,フェロトーシス,オートファジー細胞死,ネトーシス,パータナトスについて記載しているが,第2章の非アポトーシス細胞死の歴史の年表にあるように,この本に記載されていない細胞死,例えばlysosome-dependent cell death,entosis,alkaliptosis,oxeiptosis,cuproptosisなども知られている.これらについては,第2章-2の年表(p.37)に記載されているオリジナルの文献を参照していただきたい.
3死細胞のゆくえ〔第4章(p.135〜)〕
第4章では,細胞死の排除とその後の影響について解説する.
まず,死細胞がどのように認識され,どのように貪食細胞により貪食(エフェロサイトーシス)されて効率的に排除されるかについて説明している.細胞死に伴いホスファチジルセリン(phosphatidylserine:PS)が細胞表面に現れることは知られていたものの,その分子メカニズムは不明だった.PSが細胞表面に出現するには,スクランブラーゼがcaspase-3によって切断されて活性化し,フリッパーゼがcaspase-3によって切断されて不活性化されるという2つのイベントが関与していることが明らかにされた.また,PSを認識する複数の細胞表面分子も同定され,細胞内に死細胞が取り込まれる過程も明らかになっている.
一方,死細胞は(特に早期に細胞膜破裂を伴う細胞死),細胞内容物を細胞外へと放出し,非常に強い炎症を惹起すると考えられている.死細胞から放出された内容物はdamage-associated molecular patterns(DAMPs)と総称され,DAMPsの種類や死細胞から放出されるメカニズム,またDAMPsを認識して炎症などを誘導する受容体についても記載している.
4細胞死の生理的・病理的な役割〔第5章(p.155〜)〕
第5章では,細胞死の観点からではなく,発生,虚血再灌流,老化,がん,自己免疫疾患,ウイルス感染症,神経変性疾患などにおける細胞死の役割について,それぞれの病態への関与という観点から説明している.最も重要な点は,これらの疾患の発症や進展に深くかかわる細胞死を特定してその細胞死に対する阻害剤などを用いることで,新たな治療法を開発することができる可能性が指摘されていることである.これまでの研究から,アポトーシス阻害剤をさまざまな病態モデルに投与しても,病態の改善はなかなか得られないことが知られている.ただし,例外としてはBcl-2阻害剤のVenetoclaxがB細胞白血病の治療薬として認可され,臨床で使用されている.
アポトーシス阻害剤がほかの疾患や疾患モデルであまり効果がない理由はいくつか考えられる.例えば,薬剤の半減期が短いという問題もあれば,アポトーシスが生体内で起こっている状況でcaspase阻害剤を投与すると,細胞死様式がアポトーシスからネクロプトーシスに変わる可能性もある.逆に,これを利用してIAP(inhibitor of apoptosis)阻害剤のBirinapantとアポトーシス阻害剤のEmericasanを同時に投与し,効果的にネクロプトーシスを誘導する戦略も行われている.
また,神経変性疾患のように,細胞死が数年から数十年にわたり進行する病態の場合,どのような細胞死が生じているかを明らかにすることは非常に困難である.神経変性疾患では細胞死そのものが問題ではなく,“神経細胞がまず機能不全に陥り最終的に細胞が死に至るという段階をたどる” と考える研究者も多く,細胞死そのものを阻害しても十分な効果が得られない可能性がある.
5細胞死についての実験手法〔第6章(p.217〜)〕
第6章では,細胞死の実験手法について解説する.また,細胞死を評価するための解析手法や,その手法の特異性,結果の解釈などについての注意点を記載している.古い論文を読む際に役立つよう,現在ではほとんど用いられていない解析手法であるDNA ladderやsubG1 populationについても触れている.
時々,細胞死に関与する分子〔例えばアポトーシスであればcaspase-8や3,ネクロプトーシスであればRIPK(receptor interacting protein kinase)3やMLKL(mixed lineage kinase domain-like)〕の発現が上昇しているだけで,それらの分子が活性化しているという論旨を展開している論文を見かけることがある.
また,信頼できないMLKLやRIPK3に対するリン酸化抗体で組織を免疫染色し,陽性細胞が多数存在していることから,大量にネクロプトーシスが起こっていると言うような論旨を展開している論文もある.このようなことは,細胞死の基本原理を理解しておらず,かつどの抗体が信頼できる抗体なのかがわからずに販売会社のカタログだけを見て使用してしまった結果だと思われれる.そこで巻末には免疫染色やWestern blot法を用いて,さまざまな細胞死に関与する分子を検出するための抗体(少なくとも本書の執筆者が検証した)のリストを掲載しており,それらを購入して利用することで,特異性のない抗体を利用するミスを未然に防ぐことができる.また,どのような薬剤を用いることで目的とする細胞死を誘導または阻害できるのかを理解するために,誘導剤と阻害剤のリストも掲載している〔巻末付録-1,2(p.239,244)参照〕.
6おわりに
本書を読んで基本的な細胞死のマシナリーや検出方法を理解することで,読者の細胞死に対する理解が深まり,日本の細胞死研究が今後さらに発展することを期待したい.
参考図書
- 「Apoptotic and Non-apoptotic Cell Death」(Nagata S & Nakano H, eds), Springer, 2017
- 「Cell Death 2nd edition」(Green DR), Cold Spring Harbor Laboratory Press, 2018
- 「Live Cell Imaging」(Kim SB, ed), Humana, 2022
- 「細胞死」(三浦正幸,清水重臣/編),化学同人,2019



