序章 ウイルスベクター概略
1
オーバービュー
米国で躍進するウイルスベクターの基礎研究
平井宏和
(群馬大学未来先端研究機構・ウイルスベクター開発研究センター/大学院医学系研究科・脳神経再生医学分野)
はじめに
米国食品医薬品局(FDA)は2019年5月,スイスの製薬会社ノバルティスファーマの子会社AveXis社が開発した脊髄性筋萎縮症の遺伝子治療薬「ゾルゲンスマ」を承認した.十数人を対象とした臨床試験ではきわめて良好な成果が確認され,特に生後の早い時期にゾルゲンスマを投与された患者では,健常な子どもと変わらない発達を示した.1回の経静脈投与で治療が完結する一方,その費用は212.5万ドル(約2億3,000万円)ときわめて高額である.日本でも2020年2月26日に開催された厚生労働省の審議会でゾルゲンスマの製造販売が承認された.
脊髄性筋萎縮症は脊髄前角運動ニューロンの変性・脱落によって進行性に筋力低下と筋萎縮を呈する下位運動ニューロン病である.原因遺伝子SMN1の変異により,運動ニューロンの生存に不可欠なSMNタンパク質量が減少することが原因である.ゾルゲンスマは,正常なSMN1遺伝子をCAGプロモーター制御下で発現するアデノ随伴ウイルス(AAV)ベクターである1)2).
またB細胞性急性リンパ芽球性白血病(B-ALL)に劇的な効果をもたらすCAR-T細胞療法で使われる「キムリア」も,キメラ抗原受容体(chimeric antigen receptor:CAR)を発現するレンチウイルスベクターである.2019年5月22日に薬価収載され,その価格は1患者あたり3,349万3,407円である.今後次々にウイルスベクター治療薬の発売が予定されている.重要なことは,これらのウイルスベクター治療薬が製薬企業で開発されたものではなく,生命科学の基礎研究室で開発されていることである.基礎研究の成果がそのまま遺伝子治療薬となり,難病患者に投与され劇的な効果がみられている.日本はウイルスベクターの基礎研究者の層が薄く,この流れに取り残されつつある.今後,ウイルスベクター治療薬使用のため,日本国民は欧米の製薬企業と研究機関に莫大な金額を支払うのは間違いない.
1990年代以降飛躍的に進むウイルスベクター研究
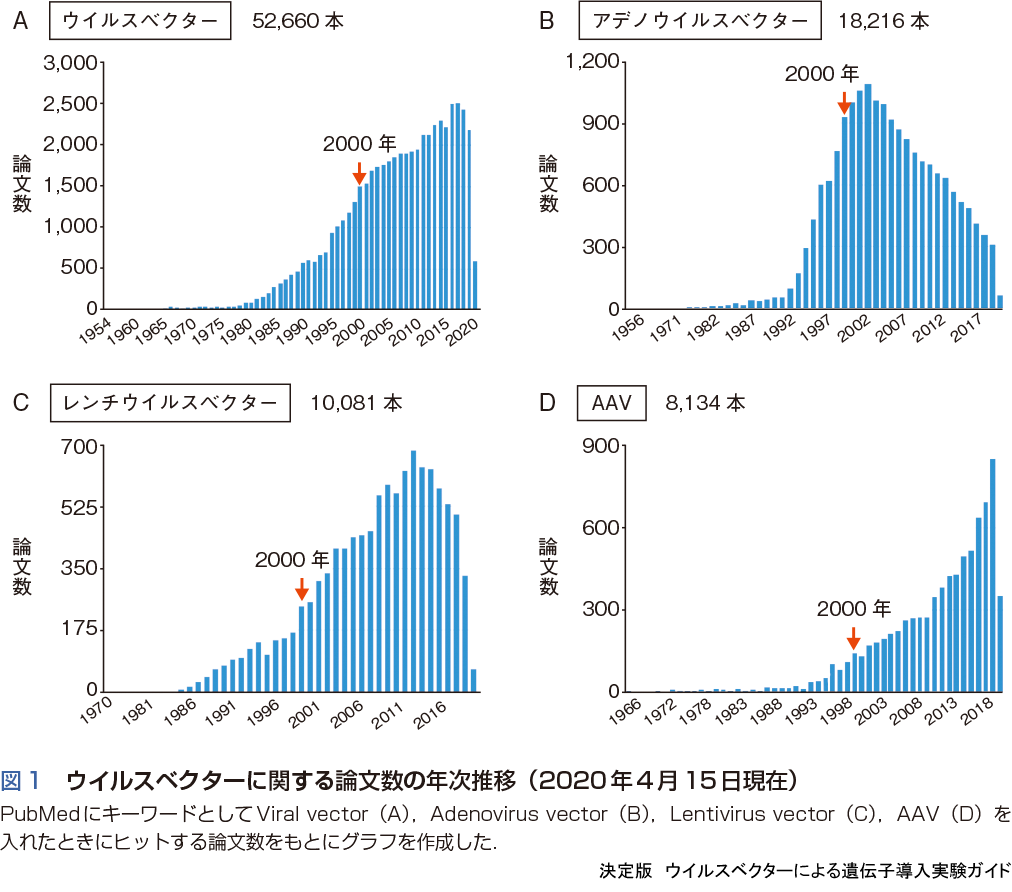
ウイルスベクターの論文数は1980年から2000年にかけて急激に増加している(図1A).これは’80年代の分子生物学の目覚ましい発展をベースにアデノウイルスベクターの開発が進み,加えて1990年以降はアデノウイルスベクターを用いた遺伝子治療の臨床試験がはじまったことで,基礎研究も過熱したためである(図1B).しかし,1999年にペンシルバニア大学でアデノウイルスベクターを用いた遺伝子治療を受けた患者が死亡したこと,2000年になってレトロウイルスベクターを用いたX連鎖重症複合免疫不全症(X-SCID)に対する遺伝子治療で顕著な効果が報告されたことから,研究者の興味はアデノウイルスベクター,レトロウイルスベクターからAAVベクターやレンチウイルスベクターに変化していった.
ヒト免疫不全ウイルス(HIV)などレトロウイルス科のウイルスをベクターとして利用する研究は,1980年代後半から本格化した.レトロウイルスベクターやレンチウイルスベクターは自身のゲノムを感染した細胞のゲノムに挿入するため,分裂する造血幹細胞でも長期にわたって安定して遺伝子発現する.それゆえ血液系の研究でさかんに用いられるようになった(図1C).2002年にレトロウイルスベクターの挿入変異による白血病の発症が報告されると,レトロウイルスベクターとレンチウイルスベクターの比較が行われ,安全性と遺伝子導入効率の両方においてレンチウイルスベクターが優れていることが明らかとなり,造血幹細胞への遺伝子導入研究はレンチウイルスベクターにシフトした.
また,レトロウイルスベクターは分裂細胞にしか遺伝子導入できないのに対し,レンチウイルスベクターはニューロンなど非分裂細胞にも効率的に遺伝子導入できることが2000年ごろから報告されはじめ,神経科学分野でもしだいに使用されるようになった.筆者は米国のセントジュード小児研究病院留学中の2001年に,血液研究室でレンチウイルスベクターが使用されているのを見てニューロンへの遺伝子導入に使えるのではないかと考え,2002年よりレンチウイルスベクターを用いたニューロンへの遺伝子導入研究を開始した.当時,神経系でレンチウイルスベクターを用いている研究者はほとんどいなかったが,ニューロンへの親和性が高く,しだいに脳神経系の研究者の間でも広まっていった.
AAVベクターも2000年ごろには作製キットが販売されており,比較的容易に使用できる環境ではあったが,当時のベクターは力価(タイター,titer)が上がりにくく,また精製に手間がかかるため,レンチウイルスの方が主流であった.しかし,2008年ごろからAAVベクターを用いたパーキンソン病やリポタンパク質欠損症などに対する遺伝子治療の臨床的有効性が報告されはじめ,臨床面でAAVベクターに注目が集まり出した.また組織特異性が異なる多くのAAV血清型が分離されたこと,ウイルス粒子の直径は22 nmときわめて小さく,脳など大きな組織においても広範囲に遺伝子導入できることなど,AAVの有用性が徐々に明らかになり,2008年以降,基礎研究でも急速に使用されるようになった(図1D).
進めるべき研究テーマ:ゾルゲンスマを例に考えてみる
AAVやレンチウイルス以外にも,アデノウイルス,ヘルペスウイルス,センダイウイルス,狂犬病ウイルスなど多くのウイルスベクターが使用されており開発も進んでいる.ここでは誌面の制約もあるため,特に発展が著しいAAVベクターに絞り,ゾルゲンスマを例に紹介する.ゾルゲンスマはユビキタスなプロモーター制御下でSMN1遺伝子を発現するAAV血清型9(AAV9)ベクターであり,2歳未満の患者に適応がある.経静脈投与のため,AAV9は肝臓や心臓など末梢臓器にも感染しSMN1遺伝子を発現する.また脳内ではターゲットとする脊髄運動ニューロンだけでなく,全脳領域の種々の細胞種に広く遺伝子発現する.
1. AAVベクターに対する宿主の免疫を抑制する研究
1)中和抗体(図2A)

ゾルゲンスマで使用されるAAV9は,経静脈投与で血液脳関門を越えて脊髄運動ニューロンにSMN1遺伝子を発現させる.現在知られているAAV血清型のなかで,AAV9は最も血液脳関門を通り抜ける能力が高いためこのカプシドが使用されているが,抗AAV9抗体が陽性の患者には投与できない.2歳未満では中和抗体が産生されている割合はかなり少ないが,今後,成人を対象とする遺伝子治療の臨床応用を考えると中和抗体を回避する研究は重要なテーマである3).
2)細胞免疫(図2B)
高力価のゾルゲンスマを投与された患者では,肝臓のトランスアミナーゼ上昇がみられた4).これは肝細胞に取り込まれたAAV9のカプシドが分解され,MHCクラスⅠによりカプシド抗原が細胞表面に提示された結果,細胞傷害性T細胞が肝細胞を攻撃したためである5)〜7).この細胞免疫を抑えるためにステロイドが投与されているが4),安全な治療のために細胞傷害性T細胞による攻撃を回避,あるいは弱める手法の開発が望まれる.
3)脳内の免疫(図2C)
静脈内に投与されたAAV9は,血液脳関門を越えて脳内に侵入する.ウイルスが侵入するとミクログリアをはじめとした脳内免疫系の活性化が考えられる.アデノウイルスベクターなど他のウイルスベクターに比べてAAVは免疫原性がかなり低いことが知られているが,経静脈的に大量のAAVが投与された場合,脳内免疫系の活性化による副作用が懸念される.
2. 血液脳関門を透過するカプシド変異体
AAV9は他の血清型に比べて血液脳関門を効率的に通り抜けるが,それでもごくわずかな脳実質細胞でしか遺伝子発現はみられない.ゾルゲンスマ投与の対象となる2歳未満の子どもは血液脳関門が未熟であり,成人よりは多くのAAV9が脳実質まで到達することができるが8),やはりそれでも十分ではなく高力価のゾルゲンスマ投与が必要となり,肝障害など副作用の危険が高まる.
2016年にカリフォルニア工科大学のDevermanらのグループによって,マウスを用いたスクリーニングで,AAV9の40倍以上の血液脳関門透過性をもつAAV9カプシド変異体,AAV-PHP.Bが報告された9).われわれはすぐにAAV-PHP.Bを作製し,マウスの静脈内に投与したところ,きわめて効率的に血液脳関門を透過して全脳領域で外来遺伝子が発現していることを確認した.続いて,AAV-PHP.Bがマウスだけでなく霊長類の血液脳関門も効率的に透過するのかを,マーモセットを用いて検討した.その結果,マウスと違ってマーモセットでは血液脳関門を透過する能力は,元のAAV9とほとんど変わらなかった10).2019年には,AAV-PHP.Bはマウスの脳血管内皮細胞に発現するGPIアンカータンパク質(lymphocyte antigen 6 complex, locus A:LY6A)と結合することで内皮細胞を血管腔側から脳側へと透過することが報告された11)12).しかし,マーモセットやヒトではLY6Aの発現がなく13),したがってAAV-PHP.Bの血液脳関門透過性はAAV9と変わらないことが示された12)13).
現時点ではヒトを含む霊長類の血液脳関門を効率的に透過するAAVベクターは明らかとなっていない.ヒトの血液脳関門を効率的に透過するAAV変異体が開発されれば,中枢神経系に広く外来遺伝子を導入することが可能になるため,アルツハイマー病など全脳に障害が及ぶ疾患の遺伝子治療への応用が期待されている.
3. AAVベクターの細胞への結合,取り込みと核への輸送

AAVはカプシドが細胞表面の受容体と結合することで細胞への取り込みが開始する.受容体はグリカン受容体(ガラクトースやシアル酸など)および共受容体(ラミニン受容体など)が知られており,血清型により異なる.AAV7,AAV8,AAV10のグリカン受容体はわかっていない.さらにほぼすべての血清型に共通で細胞内輸送にかかわると考えられている受容体,KIAA0319L(AAVR)が2016年に明らかになった14)(図3).AAVは細胞表面の受容体に結合し,AAVRとともにエンドソームに取り込まれてトランスゴルジネットワークに入る.その後,AAVはAAVRから離れて細胞質へ遊離し核へと入る15).この一連の過程を理解し,改良することで細胞種特異的,かつ効率的な遺伝子導入を実現できる可能性がある.
4. 長期的な遺伝子発現の影響
ゾルゲンスマの臨床試験がはじまってから5年が経とうとしている.パーキンソン病に対する遺伝子治療を受けた患者の剖検結果などから,AAVにより導入された外来遺伝子の発現は少なくとも5年以上,おそらく長期にわたって続くと考えられている.生後〜2歳で遺伝子治療を受けた患者は,その後,全脳で長期にわたってSMN1遺伝子を発現することになる.脊髄運動ニューロンの変性脱落は抑えられるが,明らかな異常がみられないニューロンやアストロサイトでもSMN1タンパク質産生が続く.しかし,大量のAAVが脳内へ侵入し遺伝子発現することの発達や精神機能への影響は十分に検討されていない.これまでは,致死的,あるいは症状が重篤かつ他に治療法のない疾患ゆえ,精神機能への詳細な検証が不十分ながら遺伝子治療は臨床応用されてきた.しかし,今後,さまざまな中枢神経疾患へ対象を広げるには,大量のAAVの感染,長期にわたる遺伝子発現が脳の発達や精神機能に与える影響について慎重に検証する必要がある.
文献
- Dominguez E, et al:Hum Mol Genet, 20:681-693, 2011
- Foust KD, et al:Nat Biotechnol, 28:271-274, 2010
- Verdera HC, et al:Mol Ther, 28:723-746, 2020
- Mendell JR, et al:N Engl J Med, 377:1713-1722, 2017
- Colella P, et al:Mol Ther Methods Clin Dev, 8:87-104, 2018
- Manno CS, et al:Nat Med, 12:342-347, 2006
- Mingozzi F, et al:Nat Med, 13:419-422, 2007
- Foust KD, et al:Nat Biotechnol, 27:59-65, 2009
- Deverman BE, et al:Nat Biotechnol, 34:204-209, 2016
- Matsuzaki Y, et al:Neurosci Lett, 665:182-188, 2018
- Hordeaux J, et al:Mol Ther, 27:912-921, 2019
- Huang Q, et al:PLoS One, 14:e0225206, 2019
- Lee PY, et al:J Leukoc Biol, 94:585-594, 2013
- Pillay S, et al:Nature, 530:108-112, 2016
- Pillay S & Carette JE:Curr Opin Virol, 24:124-131, 2017



