第1章 フローサイトメトリーを知る
1 ハイパラメーターフローサイトメーターの特徴について
フローサイトメーター装置の理解
田中 聡
(日本ベクトン・ディッキンソン株式会社/ 医薬基盤・健康・栄養研究所)
はじめに
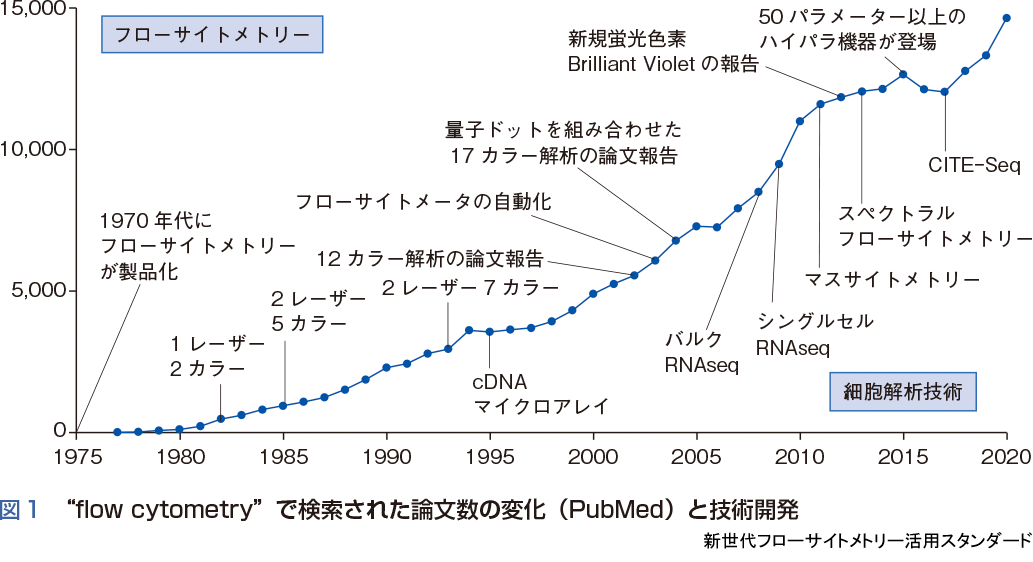
フローサイトメーターは1970 年代に製品化され,免疫学,血液学,幹細胞や再生医学に至るまで細胞生物学の研究に必要不可欠な機器として活用されている.フローサイトメトリーが研究機器として登場した以降,論文数の推移を“flow cytometry”のキーワードでPubMed から検索すると,いくつかの段階を経て,2018年頃よりその論文数は再び増加傾向にあることが読みとれる(図1).これら論文数の変化は,一つひとつの細胞からより多くの情報を引き出そうとするフローサイトメトリーの技術開発に連動しており,近年の急速な論文数の増加は,今まさにフローサイトメーターが新世代へ入ったことを示している.
2000 年代,ハイパラメーターフローサイトメーターの先駆けとなる最新のセルソーターは,大型で水冷式のガスレーザーが使用され,レーザー起動後,水流への照射位置や検出器への光路確認など,マニュアルでの光軸調整を必要とした.当時3 レーザー12カラー解析システムが “Hi-Definition(Hi-D)FACS” として紹介されたが,マルチカラー化には抗体への蛍光標識も自分で行う必要があるなど,誰もが使用できる技術には至っていなかった1).
その後,2000年代前半にマニュアルでの光軸調整を不要とした自動化されたセルソーターが導入され,研究応用が一気に加速した.使用されるレーザーも大型のガスレーザーから小型の固体レーザーとなり,新しい光学検出機構の導入,さらに量子ドット(quantum dots:QDs)など新規蛍光色素も導入され,2004年にはマルチカラーフローサイトメーターとして4レーザー17カラー解析が報告された2).その後,固体UVレーザーの開発や20パラメーター(散乱光2チャネル,蛍光18チャネル)の検出を可能としたフローサイトメーターも普及するが,QDs には広範な励起特性があるなど蛍光色素の制限から,誰もが10カラー以上の実験を組むことは依然として難しい状態が続いた.
その転機となったのは,2012年に導電性有機ポリマーを応用した新規蛍光プローブBV(Brilliant Violet)シリーズの開発となる3).BVシリーズは,高い蛍光強度とともに,その高い汎用性から今日のハイパラメーターフローサイトメーターを支える画期的なソリューションとなっている.現在は,BVシリーズから,BUV(Brilliant Ultra Violet),BB(Brilliant Blue),BYG(Brilliant Yellow Green)が開発され,近年,新たな蛍光色素としてDNA配列をバックボーンとしたNovaFluorシリーズも登場している.本稿ではこれら要素技術の進歩から,最新のハイパラメーターフローサイトメーターの特徴とその有効活用のポイントを紹介したい.
ハイパラメーターフローサイトメーターの特徴について
1.レーザーおよび光学検出器
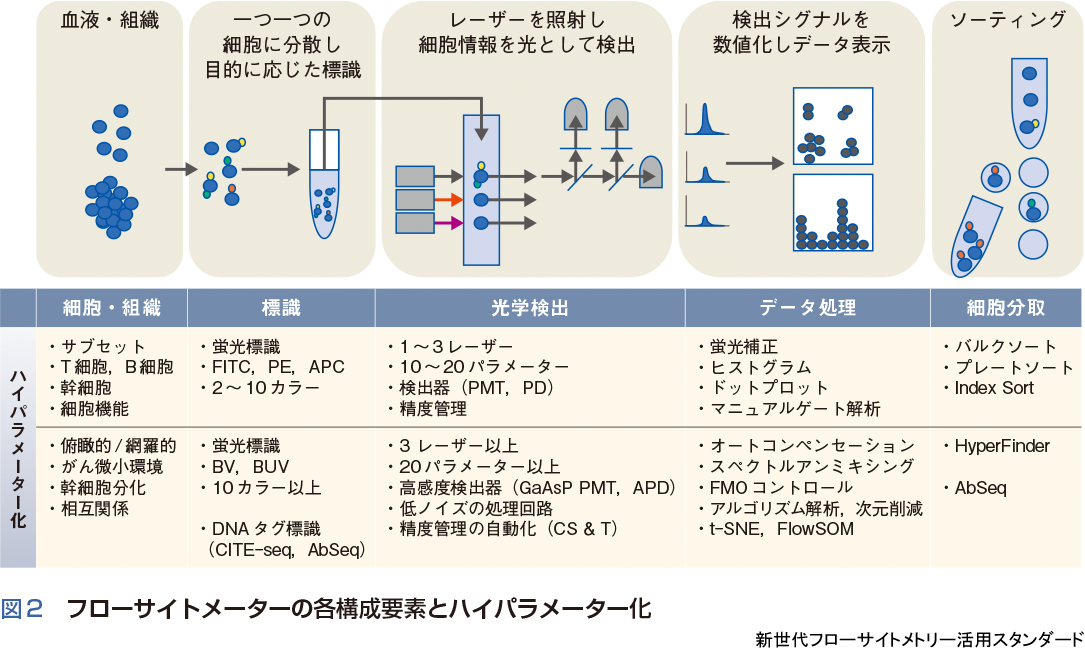
フローサイトメトリーは,細胞のもつ情報を光(散乱光や蛍光)に変換し読みとる技術であり,抗体や蛍光標識,光学検出技術,解析アルゴリズム,それらを統合するシステムより成立している.フローサイトメーターのハイパラメーター化は,特定の細胞サブセットの詳細な解析から,例えば,がん微小環境における複数のサブセット間の相互作用の解明や,幹細胞生物学における希少な幹細胞の同定など,複雑な生命現象を個々の細胞から解き明かす試行錯誤と挑戦がその開発への原動力となっている(図2).
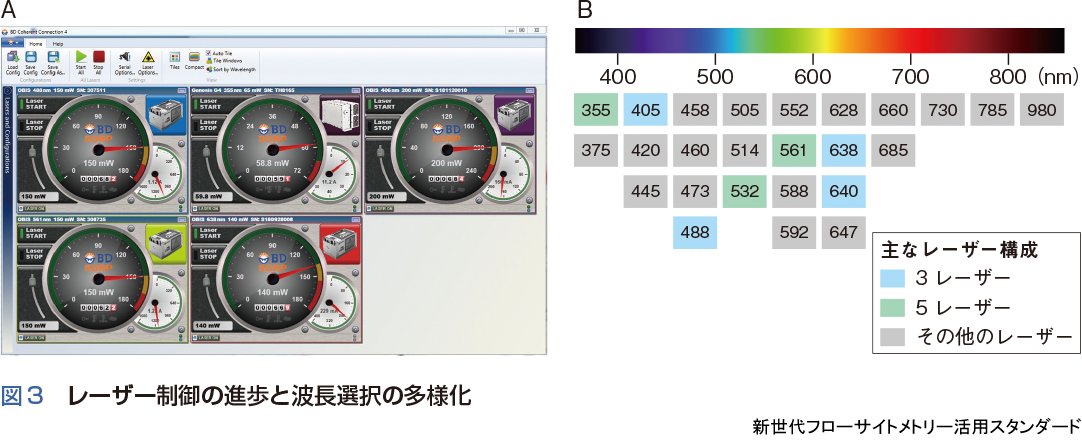
現在,広く普及しているフローサイトメーターはBlue(488 nm),Red (635 ~ 640 nm),Violet (405 nm)の3レーザーモデルとなり,近年,Yellow/Yellow Green( 532 nm, 561 nm)やUV (355 nm)を搭載した5 レーザーモデルも増加している(図3).レーザー自体も1メートル以上の大型ガスレーザーにかわり数十センチ以下の固体レーザーが導入され,フローサイトメーターの小型化が実現するとともに,マニュアルでの出力調整や波長変換は不要となり,デスクトップ上での操作も可能となっている(図3A).また,さまざまな波長帯の固体レーザーが次々に開発されており,実験目的に応じた波長選択の幅も広がっている(図3B).
また,複数のレーザーを搭載したマルチレーザー化とともに,検出器数も1レーザーあたり従来の3~5本から,10本以上を搭載するハイパラメーターフローサイトメーターも登場している.これら検出器もレーザー同様に進歩しており,光電子増倍管(PMT)の光電面を改良し量子効率を向上させたGaAsやGaAsP PMT,また,増倍率は低いが量子効率が高くコストを抑えられるアバランシェ・フォトダイオード(APD)など,それら高感度化には日本のもつ光センサ技術の貢献も大きい.分光技術に関しても光学フィルター(ダイクロイックミラー,バンドパスフィルター)の性能向上,プリズムやグレーティングの応用など,それぞれのメリットを生かした新しい光学設計をもつハイパラメーターフローサイトメーターが製品化されている.
2.ハイパラメーター化と蛍光色素の選択
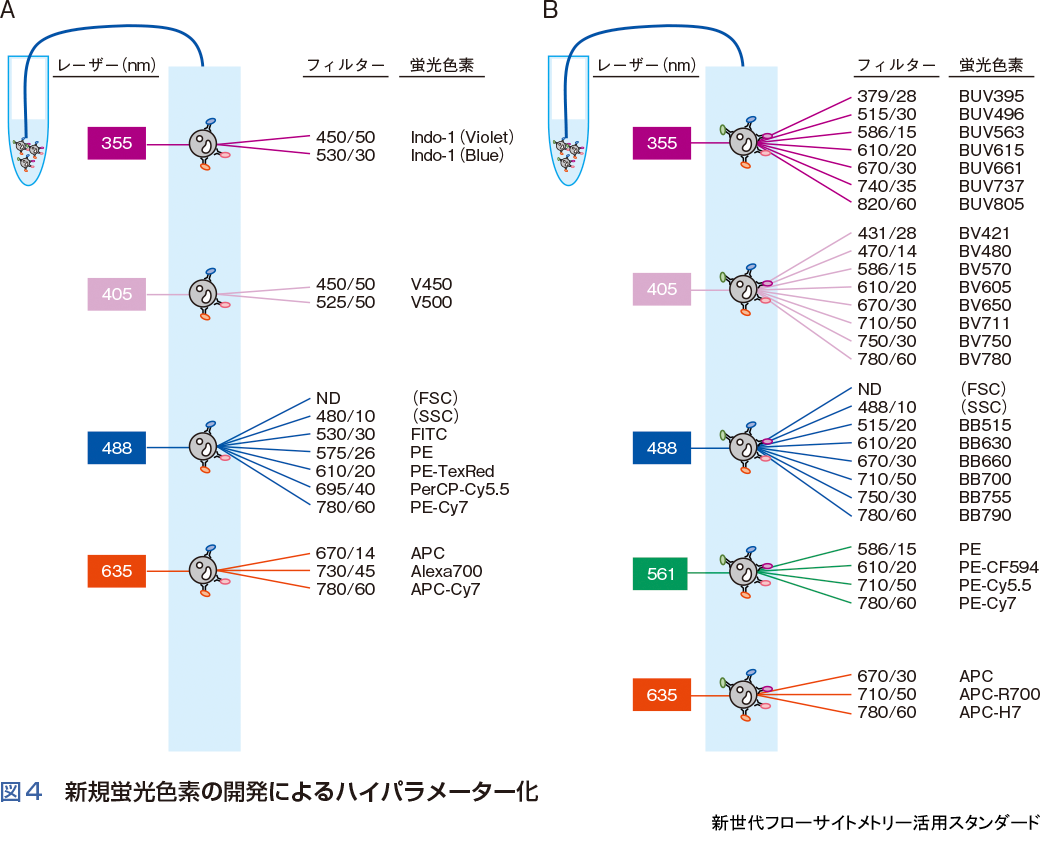
フローサイトメーターは,細胞のもつ情報を散乱光や蛍光として読みとる.そのため,光学検出技術とともに,蛍光色素の開発もハイパラメーター化において必要不可欠な要素となる.図4は10年ほど前(A)と現在(B)のハイパラメーターフローサイトメーターに用いられる蛍光色素の比較例である.
当時はBlueレーザーとRedレーザーに加えVioletレーザーが使用可能となり,V450やPacific Blue,V500やPacific Orangeの2色を追加することが可能となった.UVレーザーを搭載した機器も使用されていたが,用途としては,Indo-1を用いた細胞内カルシウム濃度測定,Hoechst 33342の染色性を利用したSide Populationによる幹細胞研究あるいは細胞周期と表面抗原の同時解析が主な用途であった(図4A).現在,BVシリーズやBUVシリーズといった新規蛍光色素の登場により,VioletレーザーやUVレーザーは,BlueレーザーやRedレーザー以上に多くの蛍光標識抗体の解析に利用できるようになった(図4B).
これら最新の蛍光色素は,光学フィルターの変更あるいはレーザーや検出器の増設等により,既存のフローサイトメーターにおいても利用が可能な場合もある.使用機材の詳細や最新の蛍光色素に合わせた光学フィルターの最適化などに関しては,各メーカーに相談するとよい.ただし,注意点としては,光学フィルターなど機器仕様の変更は個別に行わず,使用者および施設管理者へ相談したうえで実施し,変更に際しては施設内でルールを設定しておくことも重要である.
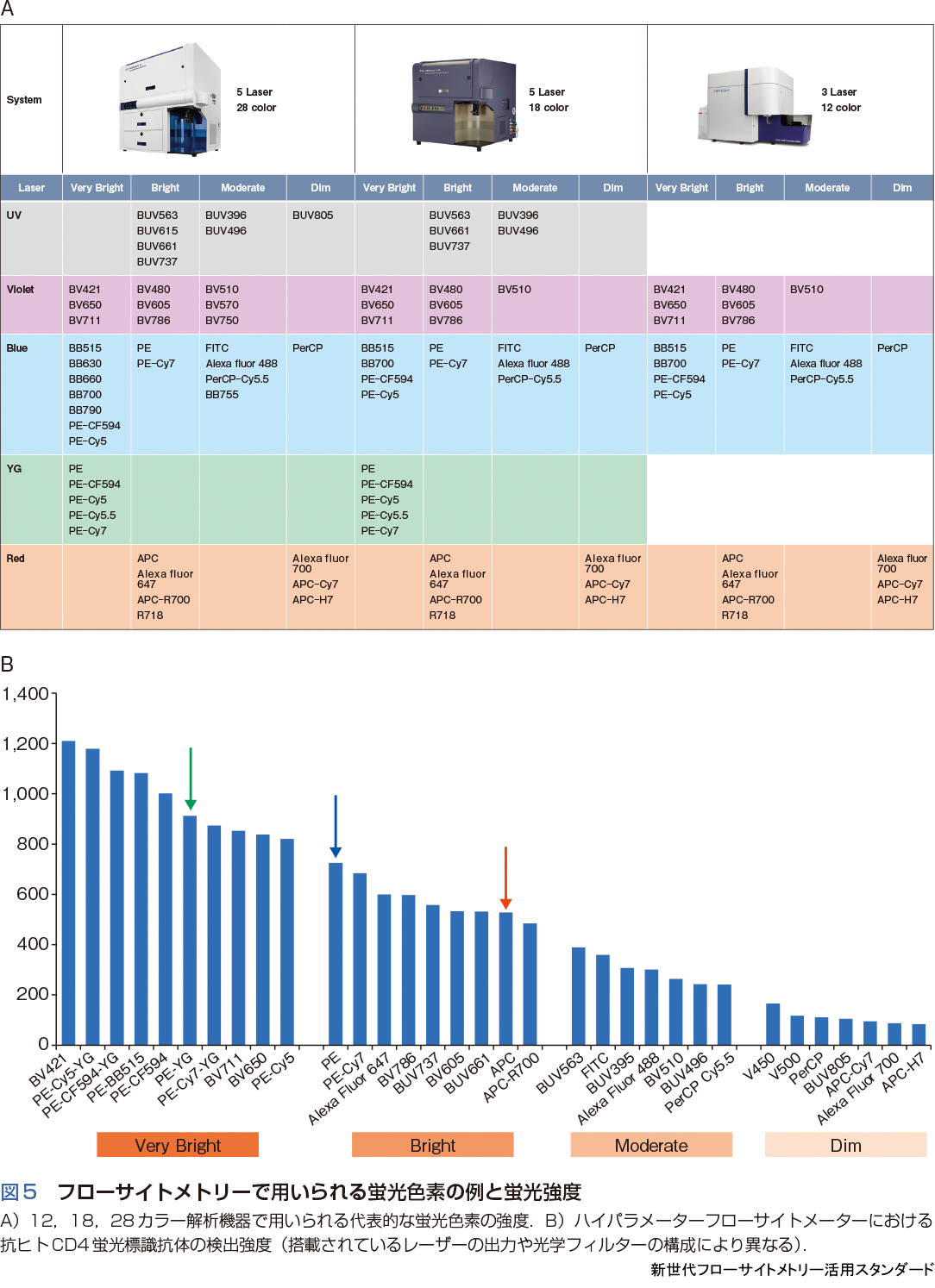
現在,フローサイトメーターで使用可能な蛍光色素は100種類を超え,さらに年々増加傾向にあり,最新情報は機器や試薬メーカーのウェブサイトを参照するとよい.また,蛍光色素の基本に関してはこれまでの実験医学別冊が参考となる4)5).図5Aに12カラー,18カラー,28カラーのフローサイトメーターを例に代表的な蛍光色素の蛍光強度を示す.汎用フローサイトメーターの場合はレーザー出力や光学系は規定されるが,ハイパラメーターフローサイトメーターでは目的に応じた選択も可能となっている.図5Bは抗ヒトCD4蛍光標識抗体を用いて,ハイパラメーターフローサイトメーターにおける蛍光強度を比較した例となる(BD Biosciences社 Human CD4 Fluorochrome Evaluation Kitを使用.Mouse CD4を用いた同様のキットもある).PEは励起レーザーをBlue からYellow Green(YG)に変更することで,より高感度に検出することが可能となる.また,BVシリーズやBUVシリーズは,これまで明るい蛍光色素とされたPEやAPCよりさらに蛍光強度が高く,VioletレーザーやUVレーザーを搭載していれば,光学フィルターの変更により既存機器でも使用することができる.
3.ハイパラメーターデータの解析からソーティング
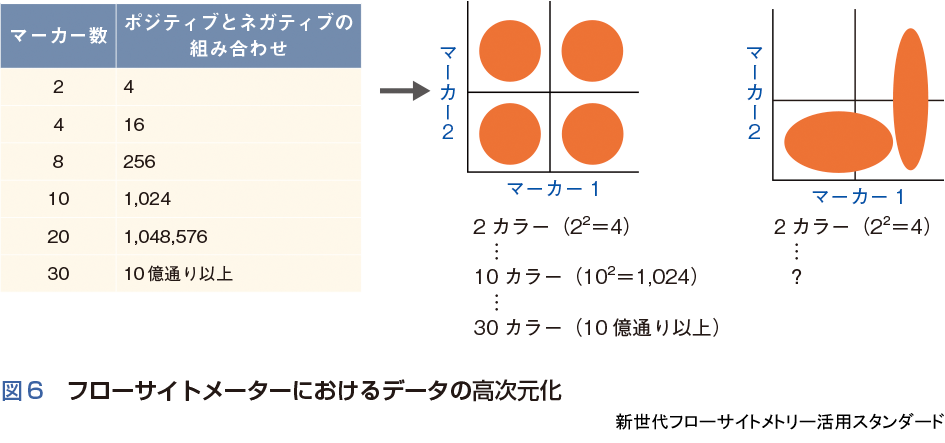
フローサイトメーターは,もともと数千個~数百万個と膨大な細胞数の解析が可能であり,さらにハイパラメーター化により,データ解析も従来法からの転換期を迎えている.例えば,蛍光をダブルネガティブ,いずれかのシングルポジティブ,ダブルポジティブの4分画として解析した場合,2カラーでは4通り,同様に4カラーでは16通りであるが,30カラーでの組合わせは10億通りを超える.また,現実にはポジティブとネガティブの集団が明確に分かれる例は少なく,その解析はさらに複雑となる(図6).これら高次元化したハイパラメーターフローサイトメーターのデータを読み解くうえでは,シングルセル遺伝子解析と同様にt-SNE など次元削減とクラスタリングのアルゴリズムの応用が必要不可欠となっている.
また,これら最新のアルゴリズムは,ハイパラメーターデータの解析だけでなく,8カラーや10カラー解析においても,ドットプロットやヒストグラムを用いたマニュアルゲーティングでは見逃されていた細胞集団が同定されることや,客観的なデータ解析にも有用であることが報告されている6)7).従来の解析手法において,最終的なゲート設定はマニュアル操作に依存することや,視覚的に分離のよいマーカーを優先してしまうケース,リンパ球やサブセットを一つの集団としてゲートしてしまうケースなど(活性化等の状態により,細胞の大きさにも違いがあり,CD3やCD4といった代表的なサブセットマーカーの発現量も変化する),新しいアルゴリズムが浸透することで,これら解析手法のばらつきも改善されていくことが期待される.
また,最近ではクラスター解析の結果から,逆に二次元プロット上で集団を再解析するGateFinder やHyperGate といったアルゴリズムが考案され,それらを組合わせたHyper-FinderがFlowJoのプラグインから利用することができる8).HyperFinder ではクラスター解析より見出された集団から二次元プロット上にゲートを設定し,そのゲートを利用したソーティングも可能としている.
4.精度管理および検出感度の最適化とメンテナンス
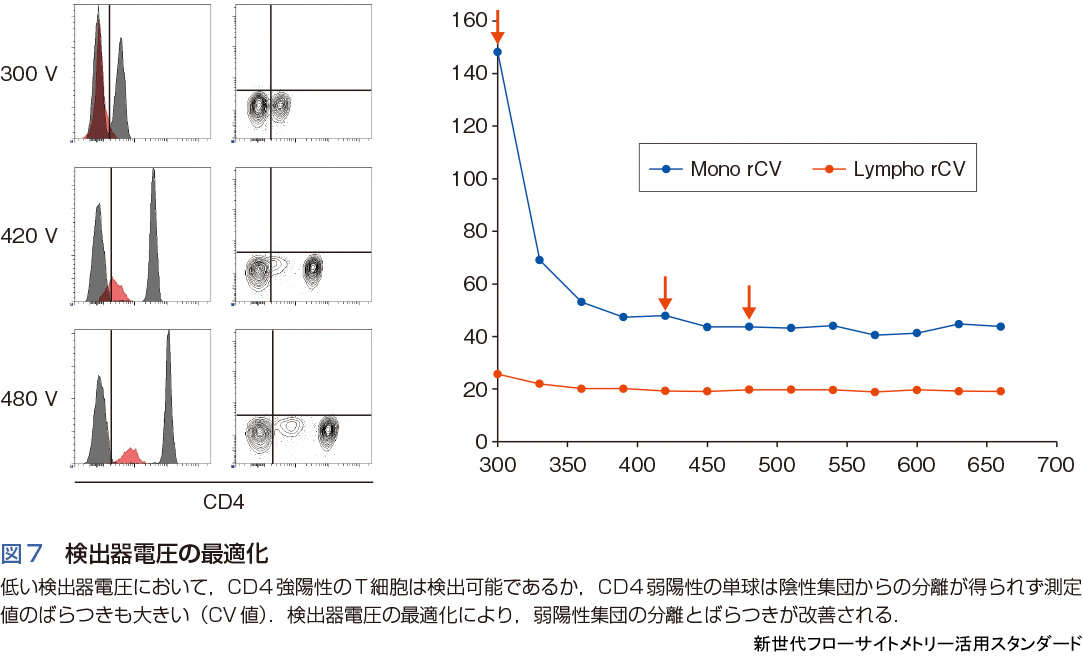
フローサイトメーターの性能を引き出すうえでは,蛍光色素の選択とともに,装置自体の検出感度を最適化することも重要となる.例えばヒト末梢血単核球をCD4蛍光標識抗体で解析した場合,CD4強陽性のT細胞は検出器電圧に大きく依存せず検出できるが,CD4弱陽性の単球の分離には検出器電圧の最適化が重要であることがわかる(図7).このように微弱なシグナルを見落とさずに検出するためには,陰性集団および装置自体がもつ電気的あるいは光学的なバックグラウンドと測定対象のシグナルを分離する検出感度の最適化が必要となる.しかしながら,フローサイトメーターのハイパラメーター化とともに,レーザーや検出器と複数の要素を,使用者自身が一つひとつ管理することは実質的に不可能となっている.
これらハイパラメーター技術の進歩から,検出感度の最適化を含め,機器の精度管理システムも刷新されている.例えばCS & T(Cytometry Setup & Tracking)のような統合的な精度管理ソフトウェアでは,大きさと蛍光強度の異なる複数の標準粒子をも用い,レーザーディレイの確認,各検出器のCV 値や直線性の確認,バックグラウンドとシグナルの分離を最適化する検出器電圧の設定を一括で行うことができる8).また,精度管理レポートの経時変化をトラッキングすることで,レーザー出力や検出感度の低下など機器トラブルを早期に発見することができる.
前述したように,レーザーや検出器性能の向上,新規蛍光色素の開発,そしてこれら精度管理システムや機器設定を含む自動化技術は,高度な専門知識を不要とし,誰もがハイパラメーターフローサイトメーターを実験に活用することを可能とした.しかしながら,フローサイトメーターは,1秒あたり数百個から数千個,1細胞あたり数μ秒から数十μ秒で連続的に解析する非常に精密な装置であることに変わりはなく,使用時の精度管理とともに,終了時の日常的な流路洗浄操作など,メーカーのインストラクションに従った定期的なメンテナンス操作が,その安定使用には必要不可欠である.
おわりに
本稿ではハイパラメーターフローサイトメーターを中心に解説したが,高度な自動化技術によってハイパラメーター解析が身近になる一方,高次元のデータ解析においては,数値に落とし込むデータの質が以前にも増して重要になる.測定機器はブラックボックス化しているが,装置の光学特性や使用する標識から抗原抗体反応まで,要素技術に関する理解の重要性はこれまでと変わりはない.これはスペクトルサイトメーターやマスサイトメーターなど,多様化するハイパラメーター解析においても同様であり,それぞれのメリットとデメリットを理解した使い分けが,質の高いデータを得るために必要となる.
今日のハイパラメーターフローサイトメーターの活用は世界的な流れとして,細胞解析技術の国際学会であるInternational Society for Advancement of Cytometry では,学会誌のCytometry Part A において,これら多様化する細胞解析技術のモデルケースをOptimized Multicolor Immunofluorescence Panel(OMIP)9)として紹介している.現時点,OMIP 078までが公開されており,ハイパラメーター解析を活用するうえでのノウハウを学ぶことができる.
また,近年,フローサイトメーターのハイパラメーター化とともに,シングルセル遺伝子解析との融合も加速している.シングルセル遺伝子解析技術の進歩から,CITE-SeqやAbSeqといったDNAバーコード抗体を用いることで,タンパク質と遺伝子の発現を同時にシーケンス解析することも可能となった10).シングルセル遺伝子解析から得られる膨大な遺伝子発現情報,表現型として細胞を網羅的に解析するハイパラメーターフローサイトメーター,両者を橋渡しするツールや統合的な解析を可能とするソフトウェアなど,フローサイトメトリーの活用はまさに新しい時代へと入っており,本稿がそれら新しい流れを研究にとり入れていくヒントとなれば幸いである.
文献・ウェブサイト
- Herzenberg LA, et al:Clin Chem, 48:1819-1827, 2002
- Perfetto SP, et al:Nat Rev Immunol, 4:648-655, 2004
- Chattopadhyay PK, et al:Cytometry A, 81:456-466, 2012
- 「新版 フローサイトメトリー もっと幅広く使いこなせる!」(中内啓光/ 監,清田 純/ 編),羊土社,2016
- 「ラボ必携 フローサイトメトリーQ & A」(戸村道夫/ 編),羊土社,2017
- Saeys Y, et al:Nat Rev Immunol, 16:449-462, 2016
- Cheung M, et al:Cytometry A, https://doi.org/10.1002/cyto.a.24320, 2021
- Cossarizza A, et al:Eur J Immunol, 49:1457-1973, 2019
- Optimized Multicolor Immunofluorescence Panel(OMIP)
- Mair F, et al:Cell Rep, 31:107499, 2020

