概論
近接依存性ビオチン標識法の原理・実際・応用
小迫英尊
(徳島大学先端酵素学研究所藤井節郎記念医科学センター細胞情報学分野)
近年開発された近接依存性ビオチン標識法は,生体内における相互作用因子やオルガネラの構成因子を大規模に同定できる強力な技術である.この方法にはいくつかの種類があり,幅広い生物種でさまざまに活用されている.本稿ではそれらの概要を紹介したい.
はじめに
多彩な生命現象の分子機構を理解するうえで,生体内におけるタンパク質間の相互作用を大規模に明らかにすることは重要である.近接依存性ビオチン標識法は,生きた細胞または個体において標的タンパク質の近傍に存在するタンパク質をビオチン標識することにより,さまざまなタンパク質間相互作用を解析できる有用な技術である1)2).ビオチン標識されたタンパク質を抽出液から濃縮し,質量分析によって大規模に同定すれば,標的タンパク質と相互作用するタンパク質の候補を多数得ることが可能である.近年,複数種類の近接依存性ビオチン標識法が開発され,幅広い生物種でさまざまな適用例が報告されている.本稿ではそれらの概要を簡単に紹介したい.
近接依存性ビオチン標識法の原理(原理編,図)
標的タンパク質に近接するタンパク質をビオチン標識する方法を触媒分子に基づいて分類すると,光応答性化学プローブ系3),ペルオキシダーゼ系,およびビオチンリガーゼ(BirA)系(広義の「BioID法」)の3種類に分けることができる(原理編-1).それぞれの研究目的に適した方法を選択するとよいが,最も簡便で一般的なのはビオチンリガーゼ系と思われる.ビオチンリガーゼ系は,さまざまな遺伝子導入法を用いてビオチンリガーゼと標的タンパク質との融合タンパク質を細胞や個体に発現(原理編-2)させることができ,ビオチン標識反応も簡便で応用範囲が広い.そのため本書では,ビオチンリガーゼ系の話題を中心に扱っている.ビオチン標識反応を行った後は,まずイムノブロットや細胞染色によって生体内のタンパク質のビオチン化が十分に起こっていることを確認し,ストレプトアビジンやTamavidin 2-REVなどのビオチン結合性タンパク質を用いてビオチン化タンパク質やビオチン化ペプチドを濃縮し,質量分析によって大規模に同定する(原理編-3)という流れが一般的である.
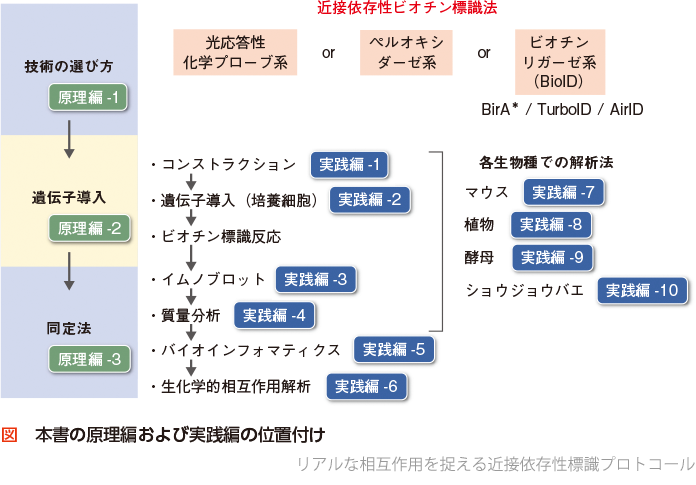
近接依存性ビオチン標識法の実際(実践編,図)
ビオチンリガーゼやペルオキシダーゼと標的タンパク質との融合タンパク質を発現させるうえで,コンストラクションには十分に注意する必要がある(実践編-1).すなわち,ビオチン標識酵素を融合する位置,リンカー配列,タグ配列,発現方法などを慎重に検討する.現在までに哺乳類培養細胞(実践編-2)だけでなく,マウス個体(実践編-7),シロイヌナズナなどの植物(実践編-8),酵母(実践編-9),ショウジョウバエ(実践編-10)などの幅広い生物種で融合タンパク質を発現させ,近接するタンパク質をビオチン標識できることが報告されている.ビオチン標識の確認には,抽出液をビオチンに特異的な抗体やHRPまたは蛍光で標識されたストレプトアビジンなどでイムノブロットするとよい(実践編-3).ビオチン標識が十分に起こっていることを確認できたら,ストレプトアビジンビーズでビオチン化タンパク質を精製し,ビーズ上でトリプシン消化してから質量分析によって大規模かつ高感度にタンパク質を同定・定量することが一般的である(実践編-4).得られた大規模データを効率的に解析し,興味深い相互作用因子の候補を抽出するうえで,さまざまなバイオインフォマティクスのツールが有用である(実践編-5).興味深い相互作用因子の候補を抽出できた場合には,検証実験が必要であり,共免疫沈降法やPLA (proximity ligation assay)法などが一般に用いられているが,無細胞翻訳系と近接依存性ビオチン標識法を利用してin vitroでの生化学的な相互作用を解析する方法もある(実践編-6).
近接依存性ビオチン標識法の応用例(応用編)
近接依存性ビオチン標識法はこれまでにさまざまな応用例が報告されている.特にSplit-BioID法では,ビオチンリガーゼをN末端断片とC末端断片に分離し,2つの標的タンパク質にそれぞれ融合することで,オルガネラ間接触部位の構成タンパク質を同定することなどが可能である(応用編-1).このようなSplit型などの改良型のビオチンリガーゼを分子設計するうえで,ビオチンリガーゼの立体構造解析の情報は有用である(応用編-2).改良型のビオチンリガーゼの一つとして,抗体のFabフラグメントとAirIDを融合したFabIDが報告されており,標的とする膜タンパク質との細胞外での相互作用タンパク質を大規模に同定することができる(応用編-3).また,抗体とHRPを用いた抗体依存的近接依存性ビオチン標識法によって特定の部位に局在する膜タンパク質を網羅的に同定することも可能である(応用編-4).さらにBioID法の応用により,従来の生化学的手法では困難であった,生体脳における細胞種選択的および細胞内局所選択的な空間プロテオーム解析が可能になった点は注目すべきである(応用編-5).最後に,サリドマイドなどのタンパク質分解誘導薬依存的なタンパク質間相互作用の解析にもBioID法は有用であり,TurboIDやAirIDなどのBioID酵素の相違点に留意しつつ活用することが期待される(応用編-6)
おわりに
近接依存性ビオチン標識法は幅広い生物種で生きた状態でさまざまに適用できることから現在非常に注目されており,普及も進んでいる.① 個体レベルでも解析可能なこと,② オルガネラ,クロマチン,液-液相分離,難溶性凝集体などの細胞内環境を維持した状態での相互作用を調べることができること,③ 酵素-基質間のような一過的・動的で弱い相互作用も調べられること,などは大きな利点である.本書では近接依存性ビオチン標識法の原理から実際,そして応用例まで網羅されており,本法を導入している,または導入しようとしている方々のお役に立てれば幸いである.
文献
- Qin W, et al:Nat Methods, 18:133-143, doi:10.1038/s41592-020-01010-5(2021)
- Samavarchi-Tehrani P, et al:Mol Cell Proteomics, 19:757-773, doi:10.1074/mcp.R120.001941(2020)
- Geri JB, et al:Science, 367:1091-1097, doi:10.1126/science.aay4106(2020)





