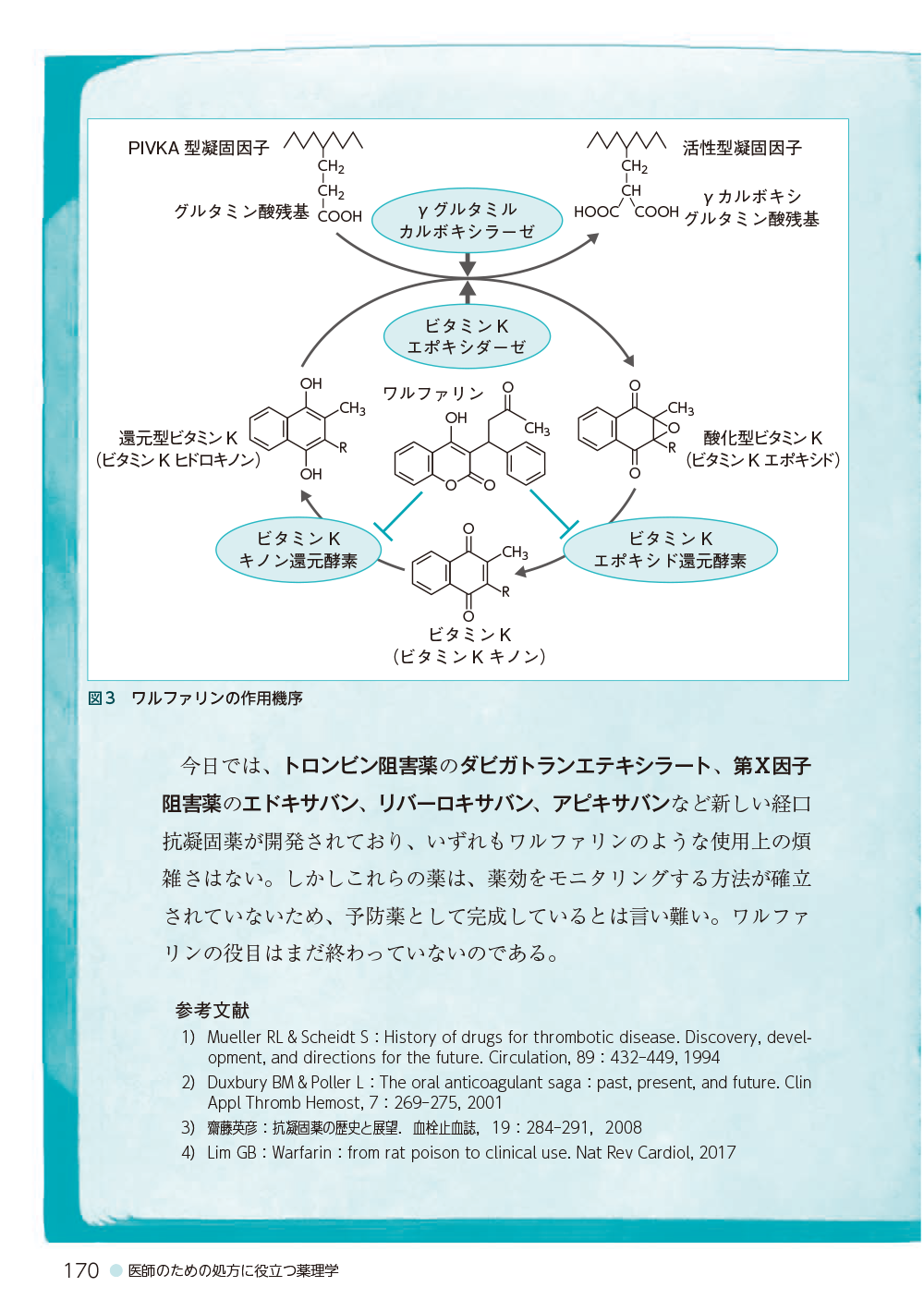
薬物治療のカスタム化
2感染症と薬
薬物治療のカスタム化
2感染症と薬
 薬物治療のカスタム化
薬物治療のカスタム化
薬剤耐性とは
感染症では、今までは効いていた薬が効かなくなるということがしばしば起こる。病原体が薬剤耐性 antimicrobial resistance(AMR)を獲得するという現象は薬の使い方とも深く関係があり、臨床的に非常に重要である。ただ、病原体といっても細菌、真菌、ウイルス、原虫などさまざまであり、これらを一括して解説するのは難しい。ここでは主に細菌の薬剤耐性について解説し、ほかは専門書に譲ることにする※9。
ある細菌に対して特定の薬が有効な場合、その細菌は当該薬に感受性 susceptibility があるという。感受性を知るには薬剤感受性試験(後述)を行う。
薬が無効なケースには、①もともと効かない場合と、②もともとは効いたが、あるときから効かなくなった場合の2つがある。両者を総称して薬剤耐性と呼ぶこともあるが、前者を不感受性 insusceptibility、後者を(狭義の)薬剤耐性と呼ぶことが多い。
臨床的に特に問題となるのは、ある細菌が作用機序の異なる2種類以上の薬に対して耐性を示す場合である。これを多剤耐性 multidrug resistance(MDR)と呼び、有効な薬はきわめて限られることになる。なお、作用機序が同じ類薬への耐性は多剤耐性とは言わず、交差耐性 cross resistance と呼ぶ。多剤耐性は、かつては突然変異(垂直伝播)によって生じるとしか考えられていなかったが、今日では、耐性遺伝子を乗せたプラスミドによる水平伝播など、突然変異以外の耐性獲得機序も存在することがわかっている。
細菌の薬剤感受性
細菌が薬に対して感受性か耐性かを判断するには薬剤感受性試験を行う。その一番大きな目的は、感染症を速やかに治癒させることにあるのはもちろんだが、感受性の低い薬を使い続けることによる耐性菌出現を抑制するという社会的な意味も大きい。
感受性試験としては、薬を加えた培地で生育阻止試験を行う。完全に生育阻止できる最低の濃度を最小発育阻止濃度 minimal inhibitory concentration(MIC)といい、MICが小さいほど薬への感受性が高いことを意味する。
薬剤感受性は時と場所によって異なるため、国や地域、病院、病棟ごとに分離された各種細菌の抗菌薬感受性データを定期的に集計し、感受性率を表やグラフで表したアンチバイオグラム antibiogramがしばしば作成される。アンチバイオグラムは、細菌の同定と薬剤感受性試験の結果が確定する
薬剤耐性の獲得
病原菌に対抗する新しい薬が使われはじめると、1年も経たないうちに耐性菌が現れることがよくある。細菌の薬剤耐性は、何らかの方法により薬剤耐性遺伝子を獲得することで生じ、いったん獲得されると子孫にも遺伝的に伝わる。
耐性遺伝子を獲得するには、①突然変異により耐性遺伝子を生じる場合と、②プラスミドの接合伝達などの方法で、ほかの耐性菌がすでにもっている耐性遺伝子を取り込む場合の2つがある。取り込まれた耐性遺伝子は、菌の遺伝子本体に組み込まれることもあるが、プラスミドとして菌の細胞質に存在することが多い。このようなプラスミドを耐性プラスミドまたはRプラスミドという。
菌と薬の攻防
1940年代に開発されたベンジルペニシリン(ペニシリン系抗生物質の原型)は、化膿性炎症を起こすブドウ球菌や連鎖球菌などに対して、当時はきわめて有効性の高い薬だった(第2章-4)。ペニシリン系抗生物質はβ-ラクタム環 β-lactam という構造をもっており、細胞壁の合成を抑制することによって細菌を殺す。ところが、やがてβ-ラクタム環を破壊する酵素β-ラクタマーゼ β-lactamase を産生する細菌が現れ、このような菌にベンジルペニシリンは無効だった。そこで、β-ラクタマーゼで破壊されにくいペニシリン(メチシリン、オキサシリンなど)が開発された。しかし、このような耐性菌用ペニシリンはさらなる耐性菌を生み出した。特にメチシリン耐性黄色ブドウ球菌 methicillin-resistant Staphylococcus aureus(MRSA)は、βラクタム系のほか、テトラサイクリン系、マクロライド系、キノロン系など多種の抗菌薬に耐性をもつ多剤耐性菌で、有効な薬はバンコマイシンやテイコプラニン、アルベカシンなどに限られ、院内感染などを起こすと治療は難渋する。さらに、バンコマイシンも効かないバンコマイシン耐性腸球菌 vancomycin-resistant Enterococci(VRE)が登場し、この菌に効く薬はごくわずかしかないという状況だ。今日問題となっている代表的な薬剤耐性菌を表3に示す。

なぜいたちごっこが起きるのか
このような「いたちごっこ」が起きるのは、薬を無効にする遺伝子を突然変異などで獲得した菌が、そうでない菌との競争に勝って増えるからだ。ただ、耐性遺伝子の獲得自体は全くランダム(無目的)に起こる現象であり、人のつくった抗菌薬が存在するかしないかには関係がない。事実、耐性遺伝子は人が薬をつくるよりはるか昔から存在したことがわかっている※10。抗菌薬が存在すると耐性菌が現れやすいのは、薬が選択圧となって感受性菌より耐性菌の方が増殖しやすくなり、耐性菌が優勢になるためである。このように、耐性菌が感受性菌を駆逐する現象を菌交代現象という。
薬剤耐性の機序
薬剤耐性のメカニズムはさまざまだが、主に次のようなものが知られている。
薬が分解/化学修飾され効かなくなる
薬を分解または化学修飾する酵素により不活性化する方法で、細菌の薬剤耐性ではよくみられる。
ペニシリン耐性黄色ブドウ球菌(MRSAを除く)やグラム陰性菌などは、β-ラクタム系抗生物質を加水分解するβ-ラクタマーゼ(クラスA:ペニシリナーゼ、クラスB:カルバペネマーゼ、クラスC:セファロスポリナーゼ、クラスD:オキサシリナーゼ)を産生し、クラスAはペニシリン系、クラスBはカルバペネム系とセフェム系、クラスCはセフェム系、クラスDはオキサシリンを含むペニシリン系の抗生物質を主な基質とする。
さらにグラム陰性菌などではクラスAまたはクラスDが変異し、ペニシリン系とセフェム系のいずれも基質とする基質特異性拡張型β-ラクタマーゼ extended-spectrum β-lactamase(ESBL)が現れ、プラスミドの接合伝達で異種の菌にも広がるので危惧されている。
標的分子が変化して薬が効かなくなる
薬の標的となる細菌の蛋白質が変異し、薬が効かないものに変わると耐性が現れる。
細菌でよく知られるものとしてはMRSAがある。最初に現れたペニシリン耐性黄色ブドウ球菌はβ-ラクタマーゼによるものだったが、メチシリン耐性の主な分子機構はそれと異なり、ペニシリンの標的分子であるペニシリン結合蛋白質(PBP)が、ペニシリン結合蛋白質2’(PBP2’)と呼ばれる変異蛋白質となっている。ほかの菌種からもち込まれた変異遺伝子がトランスポゾンなどで染色体DNAに挿入されたと考えられる。
なお、ウイルスの薬剤耐性のほとんどは、このような標的分子の変異によっている。
薬が細胞内に入れなくなる
グラム陰性菌(大腸菌、インフルエンザ菌、肺炎桿菌、緑膿菌など)の細胞質膜(内膜)には、細胞内やペリプラズム(外膜と内膜の間隙)に入った物質を細胞外に排出するポンプがいくつもある。ヒト細胞のトランスポーターとしても知られるABCファミリーやMATEファミリーなども存在するが、多剤耐性に大きく寄与するものとしてRNDファミリー resistance-nodulation-cell division superfamily (AcrBなど)が知られ、外膜チャネルTolCなどとともにRND型多剤排出ポンプ(AcrAB-TolCなど)を形成する(図4)。これらは、細胞膜内外のpHの違いによりプロトン(水素イオン)が移動することを利用して薬を排出する。また、緑膿菌はもともと抗生物質が効きにくい細菌として知られるが、その理由の1つは、緑膿菌のRNDファミリー蛋白質MexBやMexYによって形成される多剤排出ポンプ(MexAB-OprM、MexXY-OprMなど)の存在だと考えられている。
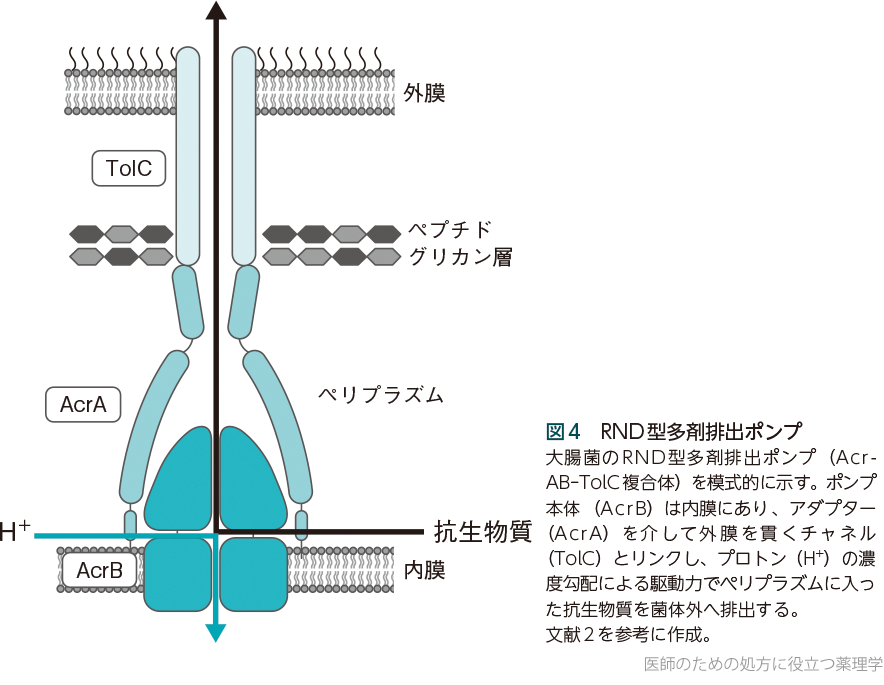
そのほか、バイオフィルム(菌膜)の形成や、グラム陰性菌の外膜透過性の変化などにより、薬が細菌細胞内に入りにくくなることも知られている。
抗菌薬の適正使用
耐性菌の蔓延を防ぐ方法としては、①耐性菌に有効な新薬を開発する、②耐性菌の発生状況を監視する、③耐性を生じにくい抗菌薬治療を行う、などが考えられる。①は重要ではあるが、まさしく「いたちごっこ」となって根本的な解決にならない。②は非常に重要だが、医師が個人としてできることは③しかない。
抗菌薬治療の原則
抗菌薬により、耐性菌の増殖に有利な環境が生まれる背景には、次の2つがある。
1つは、広域スペクトラムの抗菌薬を用いることである。フルオロキノロン系など広域スペクトラムの抗菌薬は、原因菌だけでなく多くの非耐性菌に影響を与え、耐性菌を相対的に増やして耐性菌の増殖に有利な環境が生まれる。
もう1つは、十分な量および期間の抗菌薬を用いず、過小投与してしまうことである。耐性菌といっても、高い濃度の抗菌薬に十分な時間曝露されれば増殖を抑制できることが多いが、投与される量が少なかったり期間が短すぎたりすると耐性菌が選択されてしまう。
細菌周囲の薬物濃度が、MICよりは高いが、耐性菌の出現を抑制できる濃度[耐性菌出現阻止濃度 mutant prevention concentration(MPC)]より低い場合、少なくとも理論的には、最も耐性菌が増殖しやすい環境となる。ちなみに、MICとMPCの間の濃度域を耐性菌選抜域 mutant selection window(MSW)と呼ぶ。
したがって、耐性菌の出現を防ぐために理想的な治療法は、原因菌に対してのみ著効を示す薬(抗菌スペクトルができるだけ狭く、MICができるだけ小さい薬)を、十分な量と期間、単独で用いることである。
ただ、現実にはそうはいかないことがしばしばある。
エンピリック治療
感染症の発症初期には、原因菌も有効な薬もわからないことが多い。原則としては、まず原因菌を同定し、感受性試験を行ってから抗菌薬を使うことになるが、感受性試験の結果が出るまでに早くても2〜3日かかる。その間、治療を待つことができる状況ならいいが、そのような状況は少ない。
そこで、いわゆる経験的(エンピリック)治療 empiric therapy が行われる。患者背景、症状、感染臓器、短時間でわかる検査結果などから原因菌を推定し、可能ならアンチバイオグラムを見て菌の感受性を予測し、複数の候補菌がある場合はどれにも効きそうな薬を経験的に選んで投与する。それでも有効な薬が選ばれる保証はないので、抗菌スペクトルの広い薬を選ばざるを得ないこともある。しかし、たとえこのような場合でも、菌の分離・同定と感受性試験は並行して進めておき、最も有効な薬が判明した後(必要があれば)薬を切り替える。
なお、抗菌薬を予防的に投与する必要がある状況は限られる。しっかりした根拠がないかぎり、予防的投与は避けるべきである。肺炎予防などといって風邪に抗菌薬を安易に処方する医師がいまだにいるが、これが耐性菌の蔓延を促す一因であることを認識するべきだ。
慢性感染症
もう1つ原則通りにいかないのは、治療に長時間を要する慢性感染症の場合である。たとえば結核の場合、有効な薬であっても短期間の投与では十分に菌の排除が行えないため、長期にわたる投与が必要になる。抗菌薬を長期投与すると、病原菌や常在菌などが耐性を獲得する機会が増える。
このような場合、作用機序の異なる複数の薬を併用(多剤併用)することと、計画に従った服薬を徹底させることが重要だ。
なぜ多剤併用かというと、複数の薬に同時曝露される状況で病原菌が生き残るには、すべての薬に対して同時に耐性を獲得する必要があるが、それは困難なことが多いので耐性菌の出現を抑制できるのだ。もっとも、処方が複雑化する分、有害反応や相互作用の出現には十分注意する必要がある。
また、治療が長期にわたると薬への注意が持続せず、アドヒアランスを保てなくなったり、服薬管理がおろそかになったりしがちである。服薬を勝手に中断したり、症状が悪化すると再開したりということがあると、耐性菌出現の危険性が高まる。慢性感染症では、服薬アドヒアランスやコンコーダンス(第8章-3)の重要性が特に大きい。
参考文献
- D’Costa VM, et al:Antibiotic resistance is ancient. Nature, 477:457-461, 2011
- Chen M, et al:In situ structure of the AcrAB-TolC efflux pump at subnanometer resolution. Structure, 30:107-113, 2022
 薬物治療のカスタム化
3小児と薬
薬物治療のカスタム化
3小児と薬
 薬物治療のカスタム化
薬物治療のカスタム化
子どもは小さな大人ではない
フランスの哲学者ジャン-ジャック=ルソー Jean-Jacques Rousseau(1712-1778)は、著書『エミール』※11で「子どもは小さな大人ではない」という教育論を説いたが、この考え方は小児の薬物療法にも通じるところがある。それは、薬物動態も薬理作用も、小児と成人では質的に異なっているからだ。特に薬物動態の違いは大きく、単に体重換算して投与量を決めるだけでは適切な薬物治療を行うことはできない。小児に適した薬の用法・用量は、生後の身体の発達に基づいて決めなければならない。新生児期から乳幼児期※12にかけて薬物動態は大きく変化するため、小児の薬物治療に当たっては、まずADME(吸収・分布・代謝・排泄)の生後変化について十分把握することが大切だ。
成人とは違う小児の薬物動態
吸収の違い
小腸の基本構造は胎児期にすでにつくられるので、経口投与の場合、小児であっても薬の主な吸収部位は小腸である。
❶消化管からの吸収
ただ、胃液のpHや消化管の運動性などは生後大きく変化する。出生直後は胃酸分泌能が低いため胃液のpHは6.0〜8.0だが、生後急速に低下し、3カ月頃までに成人と同じレベル(pH 2.0程度)となる。このため新生児や乳児では、薬の溶解性やイオン化率などが変動しやすく、また、胃の内容物が小腸へ送られるのに時間がかかるため吸収が遅れる。
❷小児用製剤
錠剤やカプセル剤は、新生児・乳児はもちろん、幼児や年少の小児でも服用が難しいことが多い。そのため、小児用にシロップやドライシロップ、チュアブル錠(噛んで口のなかで溶かす錠剤)などがつくられることがある。そのような剤形がない場合、成人用の製剤を粉砕するなどして飲ませることもあるが、そのような方法は正式に認められたものではないため、効果や安全性の面で懸念が残る。やはり、はじめから小児用の製剤として開発されるべきである。
❸坐剤による直腸内投与
乳幼児では経口投与に代わる方法も必要となる。なかでも坐剤による直腸内投与は、吸収が速く、痛みも少ないので有用な投与法だ。抗痙攣薬ジアゼパムの坐剤、解熱鎮痛薬アセトアミノフェンの坐剤、制吐薬ドンペリドンの坐剤などが頻用されている。
❹経皮からの吸収
一方、小児は皮膚の血流が豊かで経皮吸収は成人より良好なので、しばしば利用される。ただ新生児、特に低出生体重児※13では、表皮の角質層が薄く、吸収が過剰になりやすい。また、子どもの体表面積が体重の割に大きいことも、吸収が過剰になりやすい要因となる。たとえば、副腎皮質ホルモン薬の外用剤を長期間、広範囲に塗ると、白内障や低身長、副腎不全などの有害反応のリスクが増す。こういった場合、アンテドラッグ(第4章-2)を使用する、などの配慮が必要である。
❺注射
医療への恐怖心をいたずらに抱かせないため、小児への注射はなるべく避けたいところだが、やむを得ない場合もある。1940年代から1970年代にかけて、解熱薬や抗菌薬の頻回投与により筋拘縮症※14が発生して以来、小児への筋肉内注射はあまり行われなくなった。しかし、組織傷害性が少なく、頻回に注射する必要がないワクチンなどでは筋肉内注射の方が望ましいとも言われ、実際、海外のワクチン接種は筋肉内注射が一般的である。SARS-CoV-2(新型コロナウイルス)に対するmRNAワクチンも、蛋白質に翻訳する細胞が豊かな筋肉内に注射する。
分布の違い
❶細胞外液量が多い
水溶性の高い薬の血中濃度は、細胞外液量※15の影響を大きく受ける。小児の体の特徴の1つは、この細胞外液量が多いことだ。体重に占める水分の割合(水分率)は新生児では80%と高く、その内訳は細胞外液40%、細胞内液40%である(成人男子ではおのおの60%、20%、40%)。生後5カ月で水分率は70%に低下するが、細胞外液は30%を占め、成人の20%より明らかに多い。その後、徐々に若年成人期にかけて細胞外液量は減っていく(表4)。
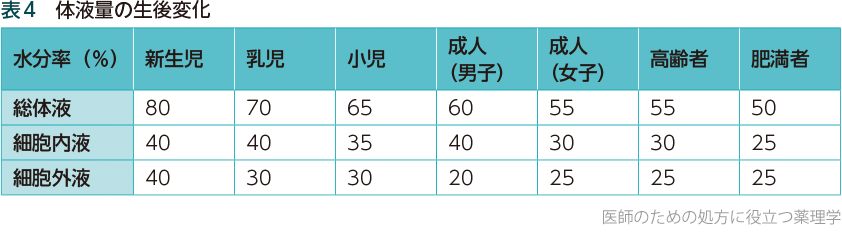
小児では、たとえばゲンタマイシンのように水溶性の高い薬は、溶け込む細胞外液が多いため血中濃度が上がりにくくなることを考慮して投与量を決めなければならない。
❷血液脳関門が未熟である
また、新生児(とりわけ低出生体重児)は血液脳関門が未熟なため、アルブミン結合性の高い薬を用いると、競合の結果アルブミンからビリルビンが遊離し、中枢神経系に移行して核黄疸を起こすことがある(後述)。
代謝の違い
小児でも、薬は主に肝臓で代謝される。小児の肝臓は体重当たりで比べると成人より重く、1〜2歳で最大となる。
❶第Ⅰ相反応
第Ⅰ相反応についてみると、CYPの活性は出生直後にはおおむね低いが、新生児期より徐々に増加し、乳幼児期には急速に上昇し、小児期にはむしろ成人以上となる(図5)。このことと、体重当たりの肝重量が成人より大きいことから、主にCYPで代謝される薬は、小児期には体重換算で大人の2倍程度を投与する必要がある。
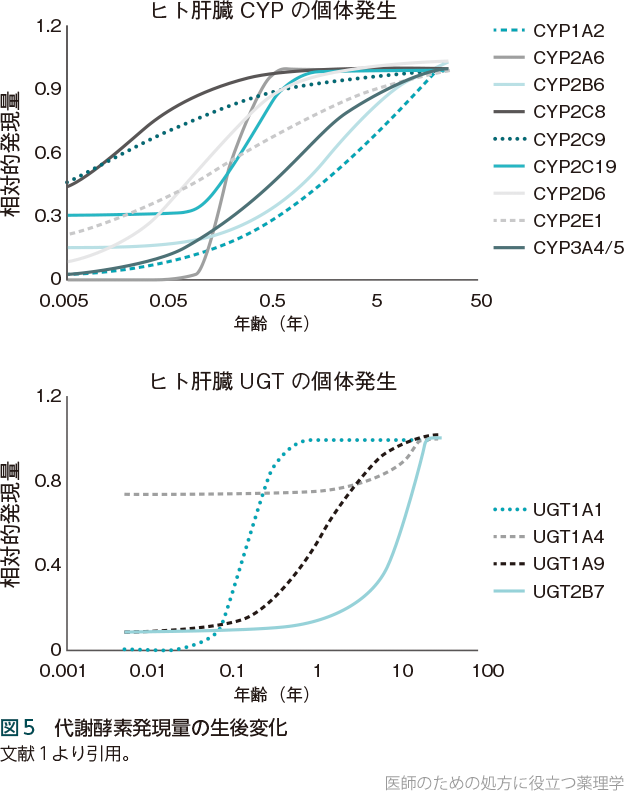
❷第Ⅱ相反応
一方、第Ⅱ相反応の代表はUGTが担うグルクロン酸抱合だが、UGTの活性は新生児では大人の約1/10しかない。UGTにも多くの種類があって生後の発達はそれぞれ異なるが、生後2カ月から3歳頃にかけて成人レベルに近づいていく(図5)。ビリルビンはUGT1A1によってグルクロン酸抱合を受けるが、出生時のUGT1A1活性はきわめて低いため、新生児には黄疸がしばしばみられる(新生児黄疸)。一方、硫酸転移酵素の活性は出生直後から比較的高いレベルにある。アセトアミノフェンは、成人ではUGT1A6によるグルクロン酸抱合を受けるが、乳幼児までは代わりに硫酸抱合で代謝される。
排泄の違い
薬の尿中排泄は糸球体濾過によるものと尿細管分泌によるものに分けられるが、いずれも新生児期の能力は低く、糸球体濾過は生後6カ月、尿細管分泌は1歳までに成人のレベルに近づく。水に溶けやすく主に腎臓から排泄されるゲンタマイシンのような薬は、細胞外液量が多いことから1回投与量は比較的多くする必要があるが、一方、腎排泄能は未熟なので投与間隔を長くする。
小児の薬用量
以上のように、薬物動態には小児と成人で大きな違いがある。では、小児への薬の投与量はどのように決めたらいいのだろうか。
残念ながら、投与量を単純に決める方法はない。薬物動態試験を実施して定められた用量が最も信頼できるが、小児で薬物動態試験が行われた薬は少ない。
そこで、年齢、体重、体表面積などを用いて成人の用量から換算する式が古くから考案されてきた。そのなかでは体表面積に基づく換算が最も合理的といわれ※16、体表面積を用いた計算式から各年齢の投与量を求めたVon Harnackの表がよく用いられる(表5)。しかしながら、すべての薬にこの表が適用できるわけではない。

そのため、「もし医薬品添付文書に年齢、体重、体表面積ごとの投与量が記載されているならばそれに従い、添付文書に記載がない場合はVon Harnackの表などによって投与量を換算する」というのが実際的だろう。特に、治療域が狭い薬では文献に基づき慎重に投与量を決定すると同時に、血中薬物濃度のモニタリング(本章-6)も考慮するべきである。
注意するべき有害反応
いくつかの薬は、薬物動態上の理由により新生児などでは禁忌となっている。
核黄疸
すでに述べたように、新生児期のUGT1A1活性は低いため、ビリルビンのグルクロン酸抱合が起こりにくい。ビリルビンは血中でアルブミンと結合しているが、これを競合的に阻害する薬(サルファ薬など)が存在すると非抱合型ビリルビンが遊離し、これが中枢神経系に移行して核黄疸※17を誘発する可能性がある。このため、サルファ薬のスルファメトキサゾールを含むST合剤は、新生児および低出生体重児には禁忌である。これと同じ理由で、セフェム系抗生物質のセフトリアキソンも新生児および低出生体重児には禁忌となっている。
灰白症候群
また、主にグルクロン酸抱合で代謝されるクロラムフェニコールは、新生児に
免疫抑制
塗布剤として用いられるアトピー性皮膚炎治療薬のタクロリムスは、血中濃度上昇による有害反応のリスクにより、小児では、年齢や製剤中タクロリムス濃度などによっては禁忌とされている。
薬力学(薬理作用)の生後変化については不明な点が多く、知識は限られているが、小児に起きやすい有害反応はいくつか知られている。重篤な有害反応を起こしうる薬では、添付文書の「禁忌」もしくは「特定の背景を有する患者に関する注意」の項に記載がある。
抗菌薬
小児で禁忌とされる薬で最も多いのは抗菌薬である。なかでもフルオロキノロン系抗菌薬は大部分(オフロキサシン、レボフロキサシン、シプロフロキサシンなど)が禁忌とされている。これらは、主に非臨床試験で認められた幼若動物の関節障害が根拠となっている。禁忌ではないものの、テトラサイクリン系抗生物質(ミノサイクリン、ドキシサイクリンなど)は歯牙着色・エナメル質形成不全や骨発育不全を起こすことがあり、「他の薬剤が使用できないか、無効の場合にのみ適用を考慮すること」とされている。
オピオイド
オピオイド性鎮咳薬(コデイン、ジヒドロコデイン)、鎮痛薬(トラマドール)、止瀉薬(ロペラミド)は呼吸抑制のリスクが指摘され、12歳未満の小児(ロペラミドは低出生体重児、新生児、6カ月未満の乳児)で禁忌とされている。また、オピオイド性麻酔薬のプロポフォールは、因果関係は明らかではないが死亡例が報告されているため、「集中治療における人工呼吸中の鎮静」を目的として小児に用いてはならないとされている。
抗ヒスタミン薬、NSAIDs
抗アレルギー薬や抗炎症薬にも禁忌またはそれに近い薬がある。第1世代の抗ヒスタミン薬(クロルフェニラミン、シプロヘプタジン、プロメタジンなど)は、呼吸抑制や、中枢神経系への抗コリン作用による痙攣などを起こすことがあり、新生児や乳幼児で禁忌とされているものが多い。
NSAIDsは一般的には禁忌ではないが、インドメタシン関連薬には有害反応のリスクにより禁忌に近い扱いになっているものがある。
適応外使用という問題
小児の薬物治療について書いてきたが、実際には小児の臨床薬理学的データは乏しく、多くの場合、薬物治療は成人の用法・用量に基づいて実施されている。そもそも、小児科で用いられている薬のなかには、小児に対する安全性は確立していないことが添付文書に記載されているものが40%ほどもあり、また小児への適応について記載がないものが30%ほどもある。つまり、合わせて約70%の薬がいわば適応外使用※19されているのである。これは、小児を対象に行われる臨床試験が少ないためで、現状では、小児に対する有効性・安全性が保証されていない薬を使わざるを得ないということだ。小児を対象とした臨床試験の充実は今後の大きな課題である。
参考文献
- Abduljalil K, et al:Changes in individual drug-independent system parameters during virtual paediatric pharmacokinetic trials: introducing timevarying physiology into a paediatric PBPK model. AAPS J, 16:568-576, 2014