概論
非膜オルガネラによるストレス応答制御
Regulation of biological stress responses by membrane-less
organelles
武川睦寛
Mutsuhiro Takekawa:Division of Cell Signaling and Molecular Medicine,
Institute of Medical Science, The University of
Tokyo(東京大学医科学研究所分子シグナル制御分野)
ストレス環境下で生体が恒常性を維持するには,細胞内で起こる生化学反応を時間的,空間的に厳密に制御する必要がある.タンパク質や核酸分子の液-液相分離現象が発見されて以来,生体分子の空間分布に関するわれわれの認識は大きく変容し,液-液相分離体である非膜オルガネラが細胞内を機能的に区画化して,生化学反応を制御する場として機能することが明らかにされてきた.さらに近年,このような非膜オルガネラが,ストレスに対する生体応答の制御に本質的な役割を果たしており,またその破綻がさまざまな疾患の病態にも関与することが見出され,注目を集めている.本特集では液-液相分離現象を介した生体のストレス応答機構に関する最新の知見を紹介する.
はじめに
生体を構成する細胞は,細胞内外の環境変化によってもたらされるさまざまなストレス刺激(紫外線,放射線,浸透圧・pH・温度・栄養状態の変化,活性酸素種,タンパク質変性,低酸素など)に恒常的に曝されている.このようなストレスに対する細胞応答は,生体が環境変化に適応して恒常性を維持するうえできわめて重要な根源的生命機能であり,その破綻がさまざまな疾病の病因・病態にも深く関与する.しかしながら,物理化学的刺激である環境ストレスを,生体がどのようにして感知し,細胞死や炎症をはじめとする多彩な生命現象を制御しているのか,その分子機構にはいまだ不明な点が数多く残されている.近年の研究の進展により,このようなストレスに対する細胞の感知・応答機構に生体分子の凝縮体(非膜オルガネラ)が重要な役割を果たしていることが明らかになってきた.
非膜オルガネラは,タンパク質や核酸などの生体高分子が液-液相分離現象を介して集合した結果形成される液滴状の細胞内構造体の総称である1)2).ストレス顆粒や核小体などに代表されるこのような非膜オルガネラは,液体としての性質,すなわち高い流動性を有しており,オルガネラ内外で絶えず構成分子の交換が起こっている.非膜オルガネラがもつこのような動的性質は,細胞を取り巻く環境の変化に対し,迅速かつ鋭敏に反応するうえで有利であることから,近年,これら液-液相分離体が生体のストレスセンサーとして機能すると考えられるようになってきた.さらに非膜オルガネラは,その内部に特定の生体分子を取り込んで濃縮することで,生化学反応の速度を亢進させる場となったり,また反対に,望ましくない分子を隔離してその機能を阻害する作用をも有しており,ストレスに対する細胞応答を直接もしくは間接的に制御するエフェクターとしての機能を併せもつことがわかってきた3)4).加えて,このような非膜オルガネラの機能不全が,がん,神経変性疾患,ウイルス感染症をはじめとするさまざまな疾病の病因や病態に深く関与することも示されており,創薬のターゲットとしても強く注目を集めている5)〜8).本特集では,国内外で活躍する関連分野のエキスパートを執筆陣に迎え,液-液相分離現象と非膜オルガネラによる生体のストレス応答機構に関する最新の知見を紹介したい.
1液-液相分離と非膜オルガネラ
液-液相分離(liquid–liquid phase separation:LLPS)は,液体中で物質が均一に混ざった状態から,物質の含有濃度が異なる2相の状態(希薄相と濃縮相)へと分離する現象である5).特に濃縮相は,希薄相の中で球状・顆粒状の形態(液滴)となること,また,時間とともに個々の液滴が融合してより大きな液滴へと成長していくことが知られている.このユニークな現象は人工的な高分子ポリマーを扱う物理学の世界では古くから見出されていたものであるが,タンパク質や核酸などの生体高分子も細胞内で液-液相分離を起こすことが,2009年にBrangwynneらによって初めて報告された9).彼らは,線虫の胚で形成されるP顆粒の構成タンパク質にGFPを融合してリアルタイム観察し,P顆粒が細胞内で液滴としての挙動を示すことを見出すとともに,タンパク質とmRNAの集合体であるP顆粒が液-液相分離によって形成されることを実証した.この発見以降,液-液相分離を介して構築される液滴状の生体分子凝縮体,すなわち,非膜オルガネラが相次いで同定され,この現象が細胞機能の制御に根源的かつ必須の役割を果たしていることが明らかにされてきた.また,近年の活発な研究により,これら非膜オルガネラの形成機構および性質を規定するメカニズムや,機能に関する分子レベルでの理解が急速に進んでいる.
2液-液相分離の分子機構
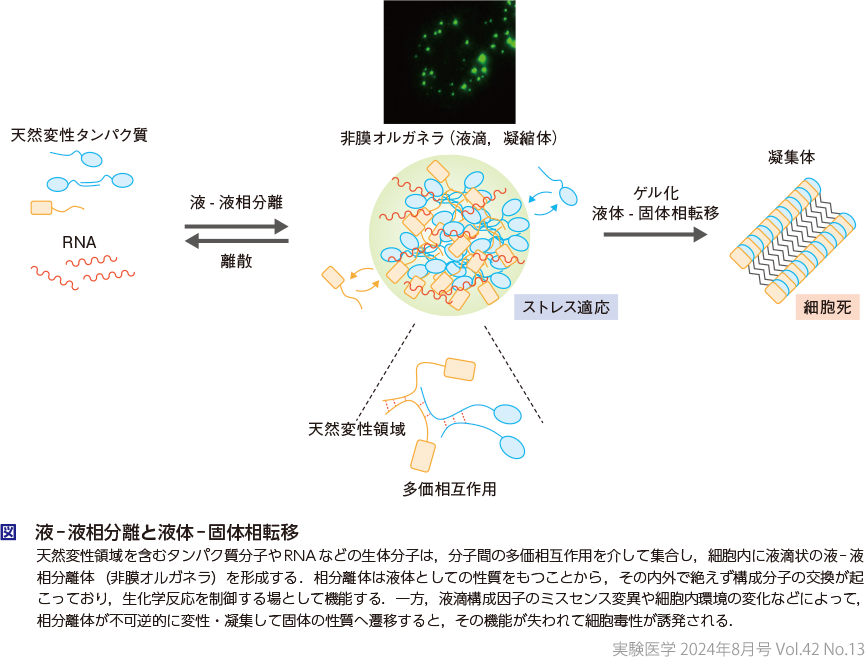
生体内で液-液相分離現象が起こる原理として,タンパク質や核酸分子間の多価(multivalent)相互作用が重要であることが明らかにされている(図)10)11).多価相互作用とは,1つの分子が,その内部に複数の結合サイトをもつことによって多くの分子と同時に相互作用することである.相分離を起こす分子は通常,1分子内に3カ所以上の結合点を有しており,多数の分子が重層的に結合してメッシュ状のネットワークを構築することで大きな構造体(液滴)が形成されると考えられている.この現象が生体分子間でも起こりうることが実験的に証明されたのは2012年である.Rosenらはタンパク質の結合モジュールとして知られるSH3(Src homology 3)ドメインと,その結合相手であるプロリンに富んだ配列(proline-rich motif:PRM)をそれぞれタンデムに複数融合させた2つのポリペプチド鎖(SH3nおよびPRMn)を合成し,これらのポリペプチド鎖を混合すると相分離が誘発されて,試験管内および細胞内の両方で非膜オルガネラ様の凝縮体が形成されることを示した12).また加藤らは,典型的な液-液相分離体であるRNA顆粒の解析から,その構成タンパク質分子の多くが,低複雑性領域(low complexity domain:LCD)とよばれる,限られた種類のアミノ酸残基でのみ構成された多様性に乏しい領域をもつことを見出した13).LCDは安定な三次元構造をとらないことから,天然変性領域(intrinsically disordered region:IDR)ともよばれている.このようなLCDやIDRは柔軟で動的な性質をもつため,タンパク質分子上で特に外部環境に曝されやすい領域であり,他のタンパク質分子やRNAなどに対して多価の相互作用を生み出す結合点となる.LCDやIDRがもたらす多価相互作用は,主にアミノ酸残基同士の弱い結合によるものであり,これまでに芳香族残基(Phe/Tyr/Trpなど)同士のπ-πスタッキングや,芳香族残基とArg/Lys残基との間で起こるπ-カチオン相互作用が寄与することや,アミノ酸残基内の電荷の偏りによって生じる双極子-双極子相互作用,水素結合なども相分離体の形成に関与することが報告されている2)10).また,LCD/IDRは静電相互作用を介してRNAとも結合し,相分離を促進する.さらにタンパク質分子がもつ自己オリゴマー化ドメイン,コイルドコイル,β-ジッパーなどの多様な結合モチーフも,分子間に多価相互作用をもたらす結合点となり,相分離を導くことが明らかにされている.
また最近の研究から,タンパク質の液-液相分離には,分子内に存在する結合点の数だけでなく,それらの分布状態も重要であることが示されている.例えば,相分離を引き起こすhnRNPA1のLCD内に存在し,結合点となる芳香族残基は,アミノ酸配列上,密集せずに比較的均等に分布しており,これが相分離に必須であることが証明されている.これらの結果から,液-液相分離には複数の結合点が互いに密集せず比較的均一に分布することが重要であるとのモデル(sticker-and-spacerモデル)が提唱されている14).
3非膜オルガネラとストレス応答
液-液相分離を介した分子集合によって形成される非膜オルガネラは,迅速な形成・分解や構成分子の流動性などに代表される柔軟な性質をもち,細胞内外の環境変化がもたらすストレス刺激に鋭敏に反応して,細胞機能を制御する役割を有している(概念図).各非膜オルガネラには多様な生体分子が含まれているが,その構成因子には一定の特異性が認められることから,オルガネラに対する親和性が高い分子はその内部に積極的に取り込まれて濃縮され,当該分子が担う生化学反応が促進される一方で,親和性が低い分子はオルガネラから排除されて,その機能が抑制されると考えられている1)〜3).また,特定の分子がオルガネラ内に取り込まれることで,本来の反応場所から隔離され,機能が阻害される場合があることも示されている15).すなわち,非膜オルガネラは,生体分子の濃縮/排除の場となって細胞内の生化学反応を時空間的に制御する機能を有している.さらに非膜オルガネラは,エネルギーが枯渇するストレス状況下で,その内部に取り込んだ生体分子を保護する役割も担っている.この作用により,ストレス刺激が除去された際には,保管した分子を直ちに利用することが可能となり,細胞がダメージから回復するのを促す.実際に,熱ショック,低酸素,小胞体ストレスなどに応答して形成される非膜オルガネラであるストレス顆粒は,顆粒内に翻訳開始因子やシグナル伝達分子,ハウスキーピング遺伝子のmRNAなど,さまざまな分子を取り込んでストレス応答シグナル(p38/JNK,mTORC1経路など)や自然免疫応答の制御,細胞死抑制など,多彩な生命機能を調節するとともに,構成分子の分解を防ぐ作用をもつことが報告されている16)〜18)(秋光の稿,小瀬・今本の稿).
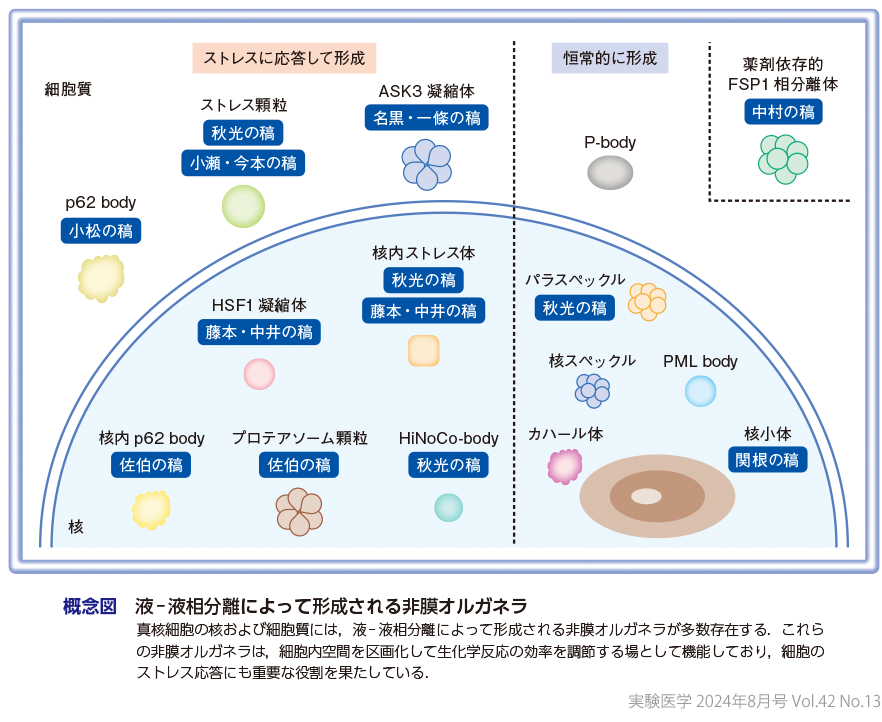
ストレス刺激依存的に形成される非膜オルガネラとしては,この他にも,熱ショック刺激に応答して形成され,mRNAスプライシングや転写制御にかかわる核内ストレス体(nuclear stress bodies:nSBs),HSF1凝縮体(藤本・中井の稿)およびHiNoCo-body(秋光の稿),ユビキチン鎖を介して相分離が誘発され,タンパク質の品質管理やストレス応答遺伝子の発現制御にかかわるプロテアソーム顆粒(プロテアソーム凝縮体)およびp62 body(佐伯の稿,小松の稿),浸透圧ストレスによって形成され,ASK3の活性制御を担う凝縮体(名黒・一條の稿),ストレス環境下で核小体内に出現し,特殊な非コードRNA(ribosomal intergenic spacer non-coding RNA)やアミロイド化したタンパク質を含むamyloid body(A-body)などが報告されている.これらのストレス誘導性の非膜オルガネラは,細胞の恒常性維持や生存など,ストレスに対する細胞の適応応答に重要な役割を果たしている4).
一方,ストレス顆粒などとは異なり,定常状態の細胞内で恒常的に形成されている非膜オルガネラも多数存在する.最近の研究から,これら常在型の非膜オルガネラも,ストレス刺激に応じてその構造や機能が大きく変化し,細胞のストレス応答に寄与することが見出されている.例えば核小体は,これまでリボソーム生合成における役割のみが注目されてきたが,近年,ストレス刺激によって相分離状態のリモデリングが誘発され,構成分子や形態が変化することでがん抑制遺伝子p53の活性化を導くことが示されている(関根の稿)1)〜3).このほか,核小体に近接して形成されるカハール体(cajal body)は,さまざまなストレス刺激に応答して崩壊し,核小体の機能制御に関与する.さらに,核内凝縮体であるパラスペックル,核スペックル,PML bodyなどもストレス環境下でその数や,形態,構成分子などが変化し,転写やRNAのプロセッシングなどを制御する.また,細胞質内に局在するP-bodyは,ストレス依存的にその数が増加することが知られており,mRNAの翻訳抑制や分解を導いて遺伝子発現を抑制することが示されている.
おわりに
近年の研究から,生体分子凝縮体である非膜オルガネラが,細胞内空間を機能的に区画化して生化学反応の効率を制御する場として作用することや,ストレスに対する細胞の感知・応答に重要な役割を果たしていることが明らかにされてきた.前述のようにストレス環境下では,ストレス顆粒のようなストレス誘導性非膜オルガネラのde novo合成と,核小体のような既存の非膜オルガネラのリモデリングの両者が同時に進行することで,細胞応答が統合的に制御されている.非膜オルガネラを介したこのようなストレス刺激依存的な細胞内空間の再編成は,真核生物のみならず細菌などの原核生物でも認められることから,すべての生物に保存された普遍的メカニズムであると考えられる.
さらに最近,非膜オルガネラの制御異常が,がん,神経変性疾患,ウイルス感染症などの疾患に深く関与することが見出され,注目を集めている5)〜8).例えば,ストレス顆粒の構成因子であるFUS,TDP-43,TIA1などは,神経変性疾患の原因遺伝子でもあることが知られている.これらの分子は,遺伝子変異に伴うアミノ酸置換によってその性質が変化し,ストレス顆粒が形成されて分子集合が起こると,顆粒内で容易に変性して不可逆的な凝集体へと遷移する.すなわち,液体としての性質をもつストレス顆粒がその流動性を失って,固体としての性質へ変化する「液体-固体相転移現象」(図)が起こり,これが,生化学反応の場としてのストレス顆粒の機能喪失を招いて,神経細胞死の原因となる可能性が指摘されている(本特集では,液滴としての性質をもつ相分離体を「凝縮体」と記述し,それが変性して固体に変化したものを「凝集体」と記載することとする).このような背景から,液-液相分離体をターゲットとした疾患治療法の開発や創薬研究が積極的に進められている.さらに最近,特定のタンパク質分子と結合することで,当該分子の液-液相分離を強制的に誘発する化合物なども見出されており,疾患治療への応用が期待されている(中村の稿).液-液相分離による生体ストレス応答機構の研究は,いまだ緒に就いたばかりの黎明期にあると思われるが,ここ数年来の研究によってその重要性が広く認識され,急速に研究が進展している.非膜オルガネラが織りなす生命現象の本質的理解は,神経変性疾患やがんなどをはじめとする社会的要請の高い難治性疾患の克服につながるブレークスルーとなることが強く期待される.
文献
- Subramanya AR & Boyd-Shiwarski CR:Annu Rev Physiol, 86:429-452, doi:10.1146/annurev-physiol-042222-025920(2024)
- Moses D, et al:Trends Biochem Sci, 48:1019-1034, doi:10.1016/j.tibs.2023.08.001(2023)
- Alberti S & Hyman AA:Nat Rev Mol Cell Biol, 22:196-213, doi:10.1038/s41580-020-00326-6(2021)
- Fefilova AS, et al:Int J Mol Sci, 23:5010, doi:10.3390/ijms23095010(2022)
- Mehta S & Zhang J:Nat Rev Cancer, 22:239-252, doi:10.1038/s41568-022-00444-7(2022)
- Peng PH, et al:Am J Cancer Res, 11:3766-3776(2021)
- Cui Q, et al:Neuron, doi:10.1016/j.neuron.2024.04.025(2024)
- Liu D, et al:Trends Immunol, doi:10.1016/j.it.2024.04.009(2024)
- Brangwynne CP, et al:Science, 324:1729-1732, doi:10.1126/science.1172046(2009)
- Holehouse AS & Kragelund BB:Nat Rev Mol Cell Biol, 25:187-211, doi:10.1038/s41580-023-00673-0(2024)
- Nesterov SV, et al:Biochim Biophys Acta Mol Cell Res, 1868:119102, doi:10.1016/j.bbamcr.2021.119102(2021)
- Li P, et al:Nature, 483:336-340, doi:10.1038/nature10879(2012)
- Kato M, et al:Cell, 149:753-767, doi:10.1016/j.cell.2012.04.017(2012)
- Martin EW, et al:Science, 367:694-699, doi:10.1126/science.aaw8653(2020)
- Fujikawa D, et al:Curr Biol, 33:1967-1981.e8, doi:10.1016/j.cub.2023.04.012(2023)
- Arimoto K, et al:Nat Cell Biol, 10:1324-1332, doi:10.1038/ncb1791(2008)
- Arimoto-Matsuzaki K, et al:Nat Commun, 7:10252, doi:10.1038/ncomms10252(2016)
- Ripin N & Parker R:Cell, 186:4737-4756, doi:10.1016/j.cell.2023.09.006(2023)
本記事のDOI:10.18958/7529-00001-0001666-00
著者プロフィール
武川睦寛:1994年博士号(医学)を取得.内科医として勤務後,基礎研究の道へ進み,大阪大学微生物病研究所,Harvard大学Dana-Farberがん研究所,札幌医科大学,東京大学医科学研究所,名古屋大学環境医学研究所などを経て,2012年から現職(東京大学医科学研究所教授).がんや自己免疫疾患などの病因・病態にかかわるシグナル伝達機構,特にMAPK経路や相分離顆粒による生命機能制御を分子レベルで解明し,疾患の診断・治療に役立てることを目標に研究を進めています.



















