概論
神経シグナルによる炎症性疾患の制御機構
neurogenic inflammationの制御
Regulatory mechanisms of the inflammatory diseases by neural signaling: Regulation of neurogenic inflammation
村上正晃,北條慎太郎
Masaaki Murakami 1)〜3)/Shintaro Hojyo 1)2):Division of Molecular Psychoneuroimmunology, Institute for Genetic Medicine, Hokkaido University 1)/ Quantum Immunology Team, Institute for Quantum Life Sciences, National Institute for Quantum and Radiological Science and Technology 2)/ Division of Molecular Neuro-
immunology, Department of Homeostatic Regulation, National Institute for Physiological Sciences 3)(北海道大学遺伝子病制御研究所分子神経免疫学分野1)/量子科学技術研究開発機構量子生命科学研究所量子免疫学研究チーム2)/生理学研究所生体機能調節研究領域分子神経免疫研究部門3))
最近の研究により個々の神経回路(神経シグナル)がどのように働き炎症性疾患を誘導するかが徐々に明らかになってきた.本特集は,神経シグナル分野の専門家の先生方に「neurogenic inflammationの制御」をめざした研究を解説いただくものである.neurogenic inflammation(神経原性炎症)とは,神経シグナルの異常が関与する炎症性疾患であるが,神経回路が全身にくまなく分布することから,ほとんどの炎症性疾患の発症に関連すると考えられており,基礎的な神経シグナル研究をもとにその臨床応用をめざす今後注目の研究領域である.本稿では,この分野の歴史的背景と最新の研究動向について概説し,炎症性疾患の発症機構の新規コンセプトや新規治療法の開発に向けての取り組みに関して議論したい.
はじめに
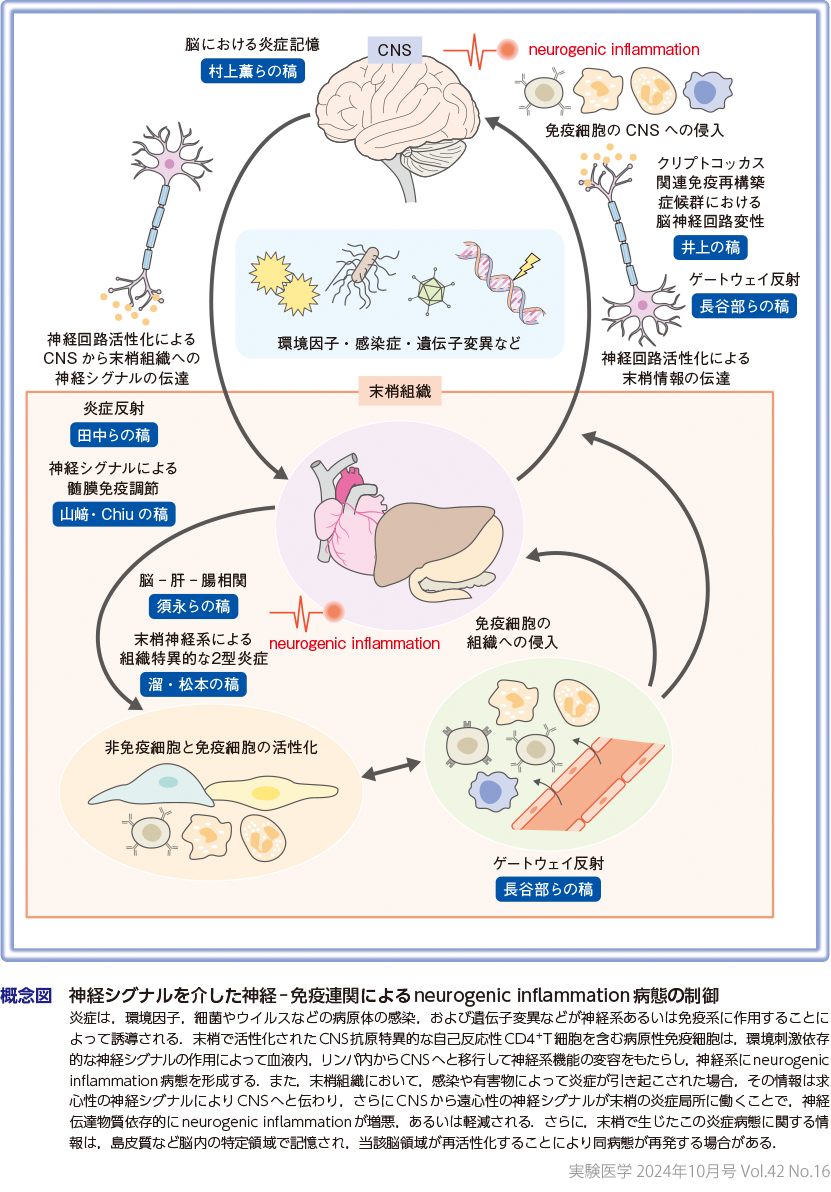
古くから,脳と脊髄からなる中枢神経系(central nervous system:CNS)は血液脳関門の存在により,免疫系による潜在的な有害作用から物理的に隔離されている「免疫特権」領域であると考えられてきた.しかし,現在では,多発性硬化症(multiple sclerosis:MS)やアルツハイマー病,てんかん,認知症および自閉症などさまざまなCNS疾患の発症に,特異的な神経回路の活性化(神経シグナル)が局所の免疫反応の変容を介して重要な役割を果たしていることが明らかになってきた.さらに,腸の炎症性疾患や,関節炎発症,全身性エリテマトーデスの重症化,肥満,および心血管疾患など末梢の炎症性疾患にも特異的な神経シグナルの活性化が関与していることがわかってきた(概念図).
1神経-免疫連関研究のはじまり
歴史的に神経科学と免疫学は,それぞれMoritz H. RombergとEdward Jennerを祖とする独立した学問体系として樹立された.この頃は,現代の「神経免疫学」の勃興につながるような両学問の学際的接点は当然存在せず,完全に独立した学問領域同士であった.その距離が縮まったきっかけは,Jean M. CharcotによるMSの診断基準の提唱と,James W. DawsonによるMSの基本病理,すなわち炎症性脱髄に関する記述であった.そのため,当初,神経免疫領域の病態解析は,CNSの中での免疫反応を解析する学問領域として発展してきた.一方で,Max Lewandowskyは血液脳関門が血液-CNS間の隔壁として働くこと,またPeter B. Medawarは皮膚片を脳に移植しても直ちに拒絶反応を受けることがないことを実験的に示したことから,血液中の免疫細胞がどのようにして「免疫特権領域」であるCNSに侵入し炎症病態を引き起こすのかが神経免疫学研究者の大きな関心事であった.その後,Thomas M. Riversが現在のMSモデルとして汎用されている実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis:EAE)の原型を開発し,またPhilip Y. PatersonがEAE病態の病因が自己反応性リンパ球であることを明らかにして研究が進展していった.
2神経シグナルによる免疫反応の制御
特定の神経シグナルによる免疫反応の制御の研究は,1920年代に発見された視床下部(hypothalamus)-下垂体(pituitary)-副腎皮質(adrenal cortex)系(HPA軸)から始まった.生体はストレスに暴露されると,脳のストレス中枢である室傍核(paraventricular hypothalamic nucleus:PVN)内の特定の神経回路の活性化によって視床下部にてコルチコトロピン(副腎皮質刺激ホルモン)放出ホルモンが分泌され,下垂体前葉に作用することで,コルチコトロピンが血中に放出される.続いてこのホルモンが副腎皮質の細胞を刺激してグルココルチコイドを全身性に分泌させる.このHPA軸にて狭義の神経シグナルと言えるのは,PVNの特定神経回路の活性化が視床下部細胞にコルチコトロピン放出ホルモンを分泌させる部分である.HPA軸では最終的に分泌されるグルココルチコイド,いわゆるステロイドが全身性の免疫反応の抑制作用を引き起こす.その後,ステロイドが単離され免疫反応の抑制剤として広く臨床応用が開始されたのが1948年である.グルココルチコイドは,副作用も多いが免疫反応の抑制効果が非常に強く現在も臨床現場にて広く用いられている.分子機構としては細胞の化学走性を低下させることでリンパ球,単球,および顆粒球の炎症部位への集積を抑制し,また未熟なT細胞やB細胞,成熟T細胞のアポトーシスを誘導すること,さらに非免疫細胞においてNF-κB経路を抑制することなどが知られている.
10年ほど前に米国ファインスタイン医学研究所のKevin J. Traceyらが発見した「炎症反射」(迷走神経活性化)による免疫反応の抑制効果は,神経シグナルの歴史にパラダイムシフトを起こした(田中らの稿を参照).迷走神経を介する神経シグナルが,全身性に炎症性疾患を抑制するのである1)〜3).言い換えると全身性の多くの炎症性疾患は,neurogenic inflammationであることが示唆されるのである.その後,多くの研究が当該研究をもとに実施され,今日では,迷走神経の人為的な活性化による炎症性疾患治療の臨床応用の可能性も試されている.2つ目の機能的な神経シグナルによるneurogenic inflammationの制御モデルは,2012年にわれわれが発見したゲートウェイ(G)反射4)〜8)であり,G反射神経シグナルは,特定血管部の透過性を局所的に変容させる(長谷部らの稿を参照).特に標的組織の抗原を認識する自己反応性免疫細胞が血中に存在すると,血管透過性が変化した部位が,組織特異的な炎症性疾患の発症の起点となる.G反射の命名はKevin J. Traceyによるが,現在6つの病態に関連するG反射が発表されている4)〜10).次いで,感覚神経,交感神経,および迷走神経を介した局所的な炎症反応の制御機構が,皮膚,肺,腸管,リンパ節など二次リンパ組織のほか,脳-肝-腸,脳-皮下脂肪などの臓器連関においても報告されてきた11)〜28).
本特集では,現在脚光を浴びている神経シグナルによる病態の制御機構について,2024年1月18日に幕張メッセにて開催された第52回日本免疫学会学術集会(中山俊憲会長)のシンポジウム「Neural signaling in Immunology」(座長:村上正晃,金井隆典)での発表者を中心に,神経シグナル分野の専門家諸氏にneurogenic inflammationの制御に関する最新の知見と臨床応用などの将来性について解説いただく.田中らの稿では炎症反射を介した免疫調節機構を,長谷部らの稿ではG反射を介した免疫調節機構を,山﨑・Chiuの稿では神経シグナルによる髄膜免疫調節機構を,村上薫らの稿では島皮質内の神経回路による炎症記憶の保存について,須永らの稿では脳-肝-腸相関による腸管免疫の制御について,井上の稿ではクリプトコッカス関連免疫再構築症候群における神経系の関与について,溜・松本の稿では末梢神経系による組織特異的な2型炎症の制御機構について解説する.
おわりに
「病は気から」の諺にあるように,神経系と免疫系は古くから,HPA軸を介した神経回路の活性化を起点とした全身性のホルモン介在性免疫制御を通して密接に関連することが知られていた.しかしながら,近年の研究により,神経系は特定の神経回路の活性化,いわゆる神経シグナルを介して免疫細胞や血管,組織細胞の活性状態を局所的に調節することで,組織,臓器の恒常性を制御し,ときにneurogenic inflammationが誘導されることが明らかになりつつあり,免疫系における神経シグナルの新しい機能が注目されている.これらの知見を利用した慢性炎症性疾患の新たな治療法の開発も試みられている.今後の研究により,さらに詳細なメカニズムの解明と臨床応用の拡大が期待される.
文献
- Borovikova LV, et al:Nature, 405:458-462, doi:10.1038/35013070(2000)
- Rosas-Ballina M, et al:Science, 334:98-101, doi:10.1126/science.1209985(2011)
- Wang H, et al:Nature, 421:384-388, doi:10.1038/nature01339(2003)
- Arima Y, et al:Cell, 148:447-457, doi:10.1016/j.cell.2012.01.022(2012)
- Arima Y, et al:Elife, 4:e08733, doi:10.7554/eLife.08733(2015)
- Arima Y, et al:Elife, 6:e25517, doi:10.7554/eLife.25517(2017)
- Hasebe R, et al:J Exp Med, 219:e20212019, doi:10.1084/jem.20212019(2022)
- Stofkova A, et al:Sci Rep, 9:2353, doi:10.1038/s41598-019-38895-y(2019)
- Matsuyama S, et al:J Immunol, 211:34-42, doi:10.4049/jimmunol.2200567(2023)
- Murakami M, et al:Immunity, 50:812-831, doi:10.1016/j.immuni.2019.03.027(2019)
- Abe C, et al:Nat Neurosci, 20:700-707, doi:10.1038/nn.4526(2017)
- Chiu IM, et al:Nature, 501:52-57, doi:10.1038/nature12479(2013)
- Cohen JA, et al:Cell, 178:919-932.e14, doi:10.1016/j.cell.2019.06.022(2019)
- Globig AM, et al:Nature, 622:383-392, doi:10.1038/s41586-023-06568-6(2023)
- Kawano T, et al:Nat Commun, 14:3831, doi:10.1038/s41467-023-39518-x(2023)
- Koren T, et al:Cell, 184:5902-5915.e17, doi:10.1016/j.cell.2021.10.013(2021)
- Liu S, et al:Nature, 598:641-645, doi:10.1038/s41586-021-04001-4(2021)
- Nakai A, et al:J Exp Med, 211:2583-2598, doi:10.1084/jem.20141132(2014)
- Pinho-Ribeiro FA, et al:Cell, 173:1083-1097.e22, doi:10.1016/j.cell.2018.04.006(2018)
- Rashid M, et al:Cell Rep, 42:112627, doi:10.1016/j.celrep.2023.112627(2023)
- Schiller M, et al:Immunity, 54:1022-1036.e8, doi:10.1016/j.immuni.2021.04.007(2021)
- Song WJ, et al:Lancet Respir Med, 9:533-544, doi:10.1016/S2213-2600(21)00125-9(2021)
- Talbot S, et al:Neuron, 87:341-354, doi:10.1016/j.neuron.2015.06.007(2015)
- Tamari M, et al:Cell, 187:44-61.e17, doi:10.1016/j.cell.2023.11.027(2024)
- Tanaka S, et al:Proc Natl Acad Sci U S A, 118:e2021758118, doi:10.1073/pnas.2021758118(2021)
- Teratani T, et al:Nature, 585:591-596, doi:10.1038/s41586-020-2425-3(2020)
- Udit S, et al:Nat Rev Neurosci, 23:157-171, doi:10.1038/s41583-021-00555-4(2022)
- Wu M, et al:Cell, 187:2935-2951.e19, doi:10.1016/j.cell.2024.04.027(2024)
本記事のDOI:10.18958/7539-00001-0001713-00
著者プロフィール
村上正晃:北海道大学獣医学部卒業後,大阪大学医学系研究科博士課程修了,大阪大学生命機能研究科准教授などを経て2014年より北海道大学遺伝子制御研究所教授,’21年より量子科学技術研究開発機構量子生命科学研究所チームリーダー,自然科学研究機構生理学研究所教授を兼務.IL-6信号と炎症性疾患の研究から炎症誘導の新規コンセプトであるIL-6アンプとゲートウェイ反射を発見した.’23年日本リウマチ財団ノバルティス・リウマチ医学賞受賞.現在,神経シグナル研究と量子生命科学技術から病気につながる微小な炎症の制御法開発をめざすムーンショット研究開発「微小炎症制御プロジェクト」を主宰している.