概論
がん研究の歴史
渋谷正史
(大学名誉教授 / 上武大学医学生理学研究所)
がん研究は,近代基礎分子生物学・細胞生物学の進歩とともに大きく発展した.19世紀以降,発がん物質の探索は進んでいたが,1970年代以降には発がん性レトロウイルス,高発がん家系,DNA型がんウイルスなどの解析により,がん遺伝子,がん抑制遺伝子が多数明らかにされた.1980年頃以降,ヒトのがんにこれら細胞内遺伝子のDNA変異が多く発見されたが,1990年代以降はDNAメチル化によるエピジェネティックな変化が多くのがんで見出された.現在では活性化がん遺伝子のみならず腫瘍血管を標的とする分子標的薬の開発が進んでいる.さらに近年,がん免疫の特徴が明らかにされ,がんに対する免疫を活性化する薬剤が臨床に登場している.
はじめに

がんの存在は人類の歴史において先史時代から認識されていたと考えられるが,具体的な研究は19世紀の医学・生物学の開始とともに始まり,近代基礎分子生物学・細胞生物学の進歩とともに大きな発展を遂げた.1970年代以降,発がん性をもつレトロウイルスの遺伝子解析に端を発し,正常細胞の染色体にはがん遺伝子となりうる候補遺伝子,いわゆるプロトがん遺伝子が数十種類存在することが明らかにされた.現在では,それらがヒトのがんの種類に対応して質的・量的に活性化し,がん化の重要な過程を担っていることがよく知られている.
一方,ヒトには高発がん家系の存在することが家系調査や疫学調査から明らかとなり,染色体解析・ゲノム解析などから,正常細胞にはがんの発症を抑える,がん抑制遺伝子が存在することが示された.細胞内に2コピー存在するがん抑制遺伝子の不活性化には,当初,さまざまな遺伝子の欠失や塩基の変異が関与することが見出されたが,その後,DNA塩基配列自身の変異以外のメチル化などエピジェネティックな変化も関与することが明らかにされた.現在,エピジェネティクス研究はがん領域に留まらず,大きく発展している.
これらのがん細胞内に生じる変化を調べ,それに対する制がん剤開発が進んでいるが,がんの制圧には至っていない.1970年代より,がん組織の微小環境,特に血管を理解し標的にしようとの考えが生まれた.その後,血管新生の分子機構に関する研究が世界的に進み,2003年にはついに腫瘍血管を標的にした薬剤が開発され,多くの固形がんに対して世界中で利用されている.
がん研究の歴史全体を正確に網羅することは筆者にとって不可能であるが,この項では上に述べた諸点を中心に概説したい(概念図).
1発がん物質の探索
19世紀において,英国の煙突掃除夫に陰嚢がんが多発すること,また,強い放射線の曝露により皮膚がんが生じやすいことが知られていた.放射線発がんの研究は分子生物学・生物物理学の発展を待たなければならなかったが,陰嚢がんの発症は石炭の煤の中に発がん物質の存在を予想させ,その検索が開始された.わが国においては山際勝三郎らによるコールタールを用いたウサギの皮膚がんの研究が行われ,1915年には転移性をもつ悪性腫瘍を発症させることに成功した.発がん研究をリードする,世界に誇るべき成果であった1).その後,発がん物質の解析は分析化学,合成化学の発展とともに非常に発展し,動物個体,培養細胞,大腸菌を用いた測定系により,タバコ煙中のニトロソアミンやベンツピレン,加熱食品中のヘテロサイクリックアミン(杉村隆ら)など多くの変異原物質が発見された(第1章参照).ただ,それらが細胞内でどのような遺伝子に変化を与えてがん化に導くのかは,大きな謎であった.
2がん遺伝子とレトロウイルス

1911年,P. Rousによりニワトリ肉腫の無細胞濾過液中に,発がん性物質〔現在はRSV(ラウス肉腫ウイルス)として知られる〕が見出された2).わが国でも3年後に藤浪艦らによりFSV(藤浪肉腫ウイルス)が報告された.1970年頃より,豊島久真男らによる温度感受性変異RSVの単離(1969年),J. M. BishopらによるRSV v-srcがん遺伝子の配列決定とc-srcの発見(1976〜ʼ80年)3),花房秀三郎らによるc-srcを取り込んだ発がん性recovered virusの単離(1977年)など,RNAをゲノムとするレトロウイルスの解析が大きく発展し,20種類近いがん遺伝子が発見された4).さらに重要な点は,レトロウイルスのがん遺伝子すべてが正常細胞内の遺伝子に由来することであり,細胞染色体内にはがん遺伝子の候補,すなわちプロトがん遺伝子(c-onc)が数十種類存在することが明らかとなった(図1).また,RSV v-Src, FSV v-Fpsをはじめ,多数がチロシンキナーゼ活性をもつこと,v-Rafなどはセリン/スレオニンキナーゼに属し,また,低分子GTP-GDP結合タンパク質であるRasも3種類見出されるなど,がん遺伝子産物の多様性とグループ化が明らかとなった(第2章-1〜4参照).
v-ErbBがん遺伝子は,EGFR(EGF受容体)遺伝子の活性化変異であることがJ. Schlessingerらにより示され,また,EGFR遺伝子は悪性膠芽腫において,正常型や活性化変異型などが高頻度で遺伝子増幅していることが報告された.さらに,EGFR関連HER2/c-erbB2/neu遺伝子は乳がんでしばしば遺伝子増幅し5),KRAS遺伝子は膵がんの90%近く,肺がんなどでも高率に活性化変異を生じることが示された6).
1990年代に,c-ABLチロシンキナーゼ遺伝子は,慢性骨髄性白血病CMLに必発する染色体 9;22転座によりBCR遺伝子と融合し,恒常的活性化を起こすことが明らかにされた.引き続き,急性白血病でさまざまな染色体転座とがん遺伝子活性化が報告された.2004年には,アジア系女性で非喫煙者の肺がんにEGFRの活性化点突然変異が多数例で見出され,世界中に大きな衝撃を与えた7).この発見は分子標的薬へと繋がっていく(表1).
3がん抑制遺伝子と高発がん家系
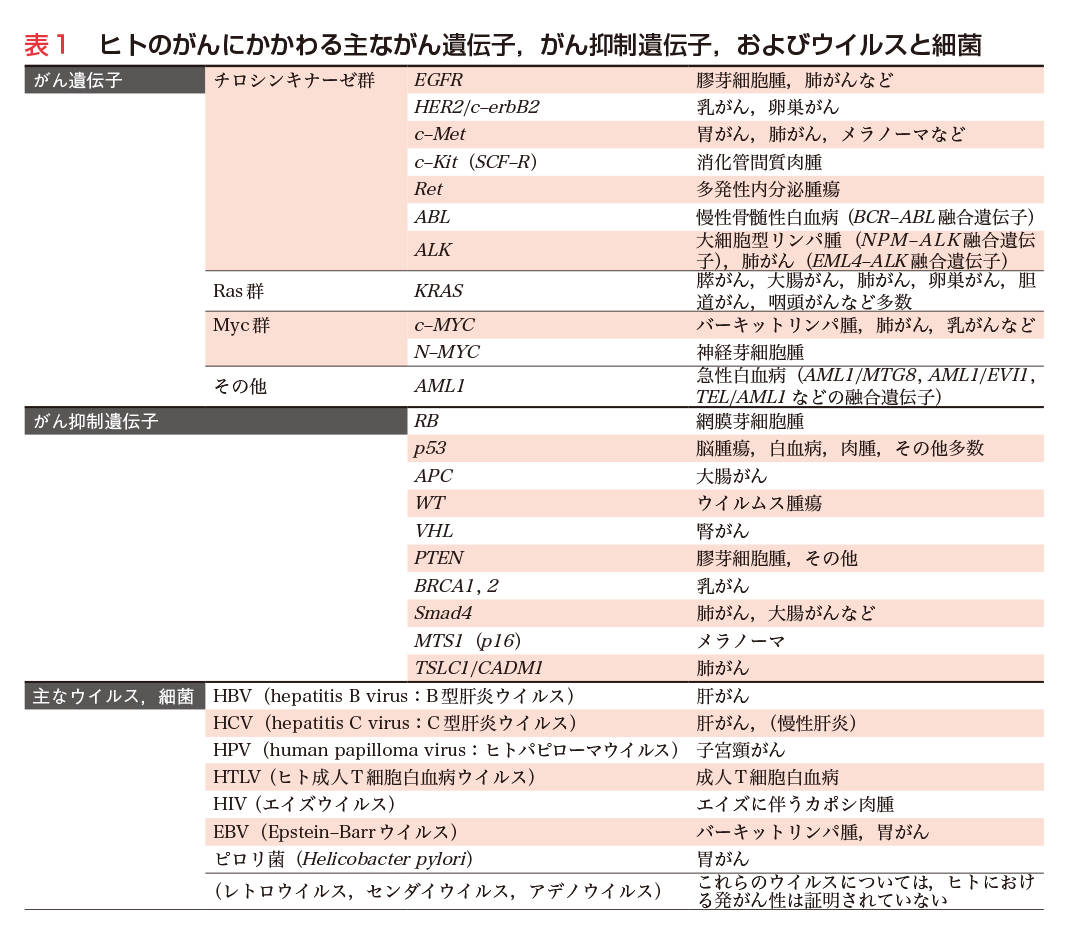

ヒトにおいては網膜芽細胞腫などにおいて高発がん家系が知られていたが,その後,家系調査や疫学調査により,Li-Fraumeni症候群(脳腫瘍,白血病,肉腫など多様ながん),von Hippel Lindau病(腎がん),大腸ポリポージス症(大腸がん),乳がん家系など高発がん家系が見出された.プロトがん遺伝子の異常が遺伝する可能性も考えられたが,1971年,詳細な家系調査をもとに,A. G. Knudsonらは細胞内に2コピーのがん抑制遺伝子が存在し,両方の遺伝子が破壊された場合にがんの発症に至るとのtwo hit theoryを提唱した.その後,遺伝子レベルの多くの解析からこの理論は基本的に正しいことが立証された.すなわち,高発がん家系においては,特定のがん抑制遺伝子の1コピーがDNA欠失や変異で不活性化され,その不活性遺伝子が遺伝的に伝えられる.細胞は残った正常ながん抑制遺伝子の働きにより発がんに至らないが,その正常機能をもつがん抑制遺伝子が何らかの原因により破壊(発現停止)された場合,発がんの重要な段階が踏み出される(第2章-4〜7,第3章参照).このように,高発がん家系は特定のがん抑制遺伝子を同定する貴重な情報を提供した.また,このことは同定されたがん抑制遺伝子は家系に属さない一般の健常人の細胞ががん化する際にも,2コピーの不活性化を介して関与しうることを強く示唆している(図2).以上の研究を背景に,RB,p53,VHL,APC,PTENなど多くのがん抑制遺伝子が見出された(表1).
非常に興味ある点は,おのおののがん抑制遺伝子とがんの種類が,ある程度対応していることである.例えば,APCは大腸がん,VHLは腎がん,BRCA1/2は乳がんなどである.この背景としては,おのおののがん抑制遺伝子が特定の組織において発現し,細胞増殖や細胞周期制御に直接かかわっていることが示されている6).
4シグナル伝達,細胞周期,アポトーシス
1980年代以降,がん遺伝子産物がチロシンキナーゼ群,Ras群,Myc群など多くの種類をもち多様な働きをもつことに関して,なぜこれらが発がん性をもつのか,相互に関連があるのか否かなど,細胞内シグナル伝達研究が盛んになった.その結果,増殖シグナル伝達機構については,EGFなどの増殖因子,その受容体(EGFR),チロシンキナーゼ活性化に続くRasの活性化,GTP型Rasからのc-Raf/MEK/MAPK経路の活性化と核内へのシグナル伝達,核内での遺伝子発現制御と細胞周期の開始,という一連の過程が進むことが明らかとなった.すなわち,主要ながん遺伝子は,このシグナル伝達経路の一員として働く(図3)(第2章〜第7章参照).
さらに,足場非依存性の細胞増殖,細胞間接着の低下,細胞遊走の促進など,細胞の正常な増殖を越えた異常な増殖が開始される.この場合には,がん遺伝子のみならず,がん抑制遺伝子の機能低下も伴うことが多い.
動物種によって,発がん過程には段階の数に差がある可能性がある.例えば,ニワトリ胎仔線維芽細胞では,v-Srcを発現させるRSV感染のみによって発がん過程がほぼ完結する.しかし,ヒトの初代培養細胞においては,in vitroの培養系でテロメレース,SV40-T-抗原,活性化H-RASの3遺伝子を導入して初めてトランスフォームできたことが報告されている6).これらの点からも,ヒトの発がんには多段階の遺伝子変化が必要と考えられるが,B. Vogelsteinらは図4のような大腸がんの多段階発がんモデルを提唱しており,多くの場合,大腸がんはこのプロセスに近い過程を経て発症するものと考えられる8)(第4章参照).
5エピジェネティクス解析によるDNAレベルの遺伝子不活性化


がん抑制遺伝子を解析するなかで,DNAレベルで欠失や塩基の変異が認められる例と,それらの変異は全く検出されないが,遺伝子発現が強く抑えられ,がん抑制遺伝子の欠失と同じ状態になる例が数多く見出されてきた.転写プロモーター領域にも変異がない例が詳しく解析され,1990年代後半よりDNA塩基配列のシステインがメチル化されている事実が多数報告された.特に,転写調節領域にCpG配列が集中した場合,それらが多くメチル化されると転写が強く抑制されmRNA量の低下を招くことが明らかとなった.このようにDNA塩基配列上は変異がないにもかかわらず,塩基の修飾により遺伝子発現が調節されることをエピジェネティックな制御と総称している(図2)9)(第3章-3参照).
がん抑制遺伝子の種類によっては,TSLC1/CADM1などのようにほとんどがDNAメチル化による不活性化である例もある.また,胃がんなどではピロリ菌が存在すると炎症状態が遅延し,DNAメチル化も起こりやすく,前がん状態へ入りやすいとの結果も出されている.DNAメチル化によるがん抑制遺伝子の不活性化を食い止める方法や薬剤の開発は,今後の発がん予防法研究のうえで非常に重要な位置を占めると考えられる.
6腫瘍血管を中心とするがんの微小環境
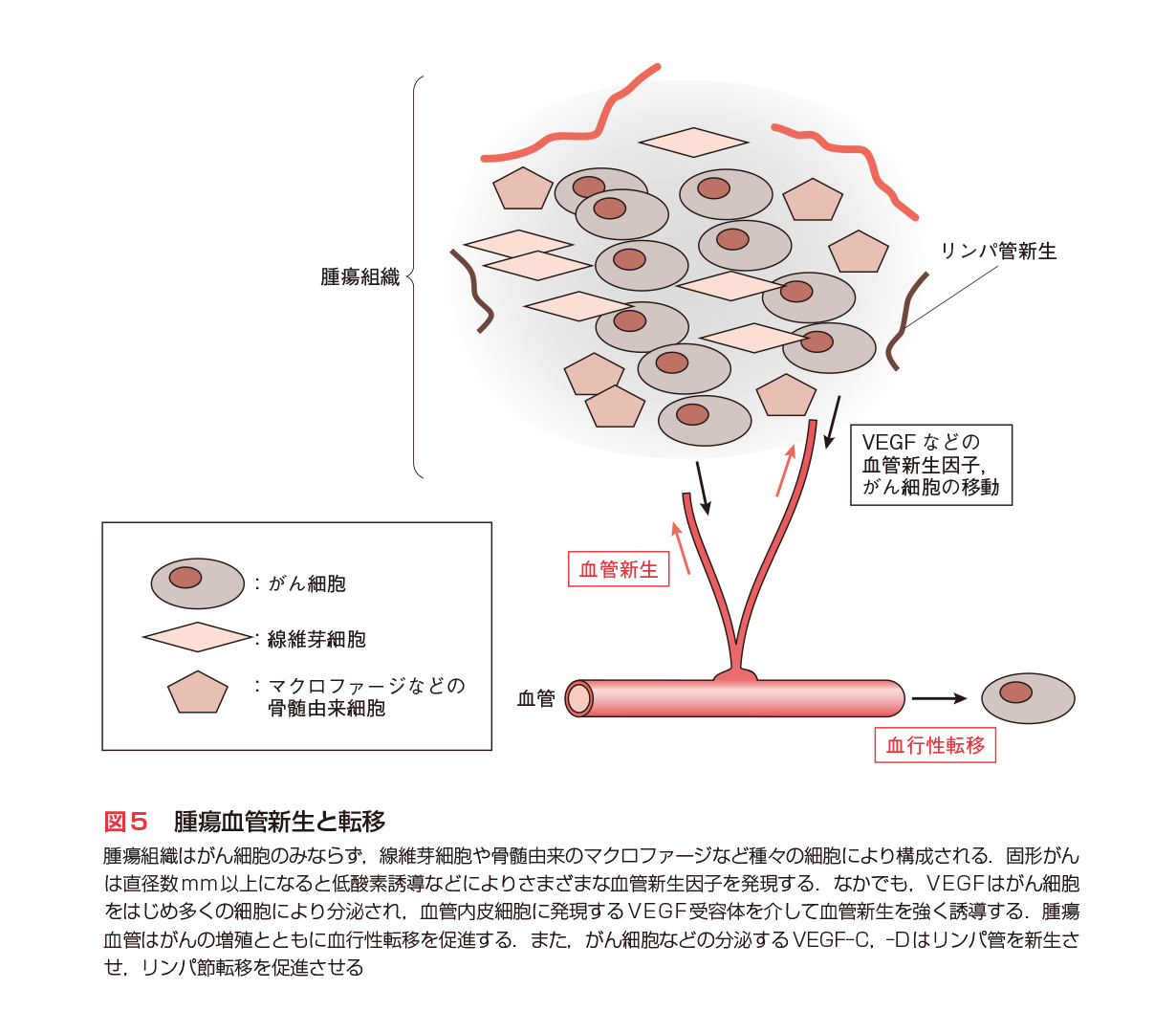
がん関連遺伝子の理解が進み,がん細胞自身を標的とするさまざまな治療法が開発されつつあるが,がんを完全緩解へ治療することは容易でない.1970年代にJ. Folkmanらは固形がんの新しい治療として,腫瘍血管を標的にし,がんを「兵糧攻め」にする考えを提唱した.その後,1980〜’90年代に血管内皮増殖因子VEGFとその受容体システムを中心に多くの血管制御系が見出され,なかでもVEGF-VEGFRが腫瘍血管形成に最も強くかかわることが明らかにされた(図5)10)11)(第5章-3,4参照).VEGFは,がんの増殖に伴う低酸素条件,強い増殖刺激,また,腎臓がんでみられるVHL変異により,発現が誘導される.2003年には抗VEGF中和抗体「アバスチン®」(ベバシズマブ:Bevacizumab)の臨床第Ⅲ相試験が終了し,従来の標準療法に抗体を加えた群では,進行大腸がん患者の生存期間が15.6カ月から20.3カ月へ大きく延長することが明らかにされた.
7浸潤と転移,がん幹細胞の問題
浸潤と転移はがんの悪性度に密接にかかわる問題であり,浸潤については細胞間接着や細胞運動の面から多くの研究が進められている.特に,間質を分解する酵素が数多く見出され,なかでもMMPファミリーは浸潤・転移に重要な役割を果すことが明らかにされた.阻害薬開発は副作用の点でやや遅れているが,近い将来,臨床に登場することが期待される(第5章参照).転移は血行性の遠隔臓器への移動(血行性転移)と,リンパ行性のリンパ節転移が基本である(図5).前者は腫瘍血管の制御,後者はリンパ管新生の制御を介して抑制することが可能と考えられ,薬剤開発が進んでいる12).
がん幹細胞については,その定義の難しさから議論が続いているが,がん細胞の集団に増殖能の高い一群があり,その性質を明らかにしてより有効な制がん法を考えようとの方針は,がん研究の草分けである吉田富三が示したがん細胞の多様性,個性とも通じて興味深い視点である.がん幹細胞の可塑性や遺伝子発現の特徴などに関して研究が進みつつある.
8分子標的薬剤の開発,および予防薬の進歩
がん抑制遺伝子は個々のがん細胞で発現や機能が失われるものであり,すべてのがん細胞にそれを補うことは容易でなく,有用な薬剤はまだ開発途上である.一方,がん遺伝子では,多くの場合,量や酵素活性の増大であるため,活性阻害薬や中和抗体の開発が進んだ.最初に大きな成果が得られたのは,CMLで活性化するBcr-Ablキナーゼの阻害薬「グリベック®」(イマチニブ:Imatinib)の開発である.この分子標的薬第一号ともいえる薬剤は,従来の治療法に抵抗性のCMLにもきわめて有効であり,劇的な治療効果をもたらした.2003年に開発されたEGFRキナーゼ阻害薬「イレッサ®」(ゲフィチニブ:Gefitinib)は副作用の問題があったが,その後発薬「タルセバ®」(エルロチニブ:Erlotinib)は広く用いられ,肺がん治療に成果をあげている.また,HER2中和抗体はHER2過剰発現乳がんに臨床効果を発揮している(図3)(第7章-1〜3参照).
現在では,血管新生阻害薬のアバスチン®は大腸がん,乳がん,肺がん(扁平上皮がんを除く),グリオブラストーマなどに,また,VEGFRを中心とするマルチキナーゼ阻害薬は腎臓がん,肝臓がんなどに有効であり臨床応用されている(第7章-4参照).ただし,血管新生阻害薬も抵抗性の問題があり,研究が続けられている.
発がんの原因・誘因となるウイルスに関しては,感染ルートとなりうる輸血の厳密な管理,感染後はインターフェロンによるウイルス増殖抑制が行われている.子宮頸がんにかかわるHPVについては2000年代後半より世界的に予防ワクチンの接種が始まっている.さらに,胃がん発症の誘因と考えられるピロリ菌についても,同時期より除菌が行われ始めている(第1章参照).
9がんに対する免疫活性化療法の進展
がんの多くは正常細胞から発生すると考えられるが,その変化により,一部は異物としての抗原性をもつことが考えられる.しかし,多くの場合,宿主側の細胞性免疫などは活性化せず,その分子機構の解明が求められていた.長年のがん免疫学研究から,近年,がんに対する免疫活性化を抑制する「免疫チェックポイント機構(PD-L1/PD-1受容体システム)」が明らかとなり,その機構を人為的に阻害する抗PD-1抗体,抗PD-L1抗体などがメラノーマや一部の肺がんに対して免疫活性化とがんの縮小を引き起こすことが示された.がんに対する免疫系抑制機構の全体像の解明が期待されるとともに,新しい領域の制がん剤として注目を集めている13)(第6章-3参照).
おわりに
近代〜現在までのがん研究の流れについて,がん遺伝子,がん抑制遺伝子など,いくつかの項目に焦点をあてて紹介した.これ以外にも,基礎分子生物学からは細胞周期,アポトーシス,オートファジーなど多くの進展があり,それらががん研究を支え,発展させてきた.1970年頃と比較するとがん研究は大きな成果をあげ,遺伝子変化を標的とした有効な治療法を開発してきたといえる.しかし,まだ多くの問題を残しており,今後の独創性に富んだ研究の発展が期待される.
文献
- 「世界初の人工発癌に成功した山際勝三郎」(小高 健/著),学会出版センター,2006
- Rous P:A SARCOMA OF THE FOWL TRANSMISSIBLE BY AN AGENT SEPARABLE FROM THE TUMOR CELLS. J Exp Med, 13:397-411, 1911
- Stehelin D, et al:DNA related to the transforming gene(s)of avian sarcoma viruses is present in normal avian DNA. Nature, 260:170-173, 1976
- Jove R & Hanafusa H:Cell transformation by the viral src oncogene. Annu Rev Cell Biol, 3:31-56, 1987
- Slamon DJ, et al:Human breast cancer:correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science, 235:177-182, 1987
- Hanahan D & Weinberg RA:The hallmarks of cancer. Cell, 100:57-70, 2000
- Lynch TJ, et al:Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med, 350:2129-2139, 2004
- Fearon ER & Vogelstein B:A genetic model for colorectal tumorigenesis. Cell, 61:759-767, 1990
- Goldberg AD, et al:Epigenetics:a landscape takes shape. Cell, 128:635-638, 2007
- Ferrara N:Vascular endothelial growth factor:basic science and clinical progress. Endocr Rev, 25:581-611, 2004
- Shibuya M & Claesson-Welsh L:Signal transduction by VEGF receptors in regulation of angiogenesis and lymphangiogenesis. Exp Cell Res, 312:549-560, 2006
- Alitalo K & Carmeliet P:Molecular mechanisms of lymphangiogenesis in health and disease. Cancer Cell, 1:219-227, 2002
- Iwai Y, et al:Cancer immunotherapies targeting the PD-1 signaling pathway. J Biomed Sci, 24:26, 2017















