概論
プロテインノックダウン技術の沿革と今後の展開
An overview and history of protein knockdown technology
内藤幹彦
Mikihiko Naito:National Institute of Health Sciences(国立医薬品食品衛生研究所)
化合物を利用して目的のタンパク質を細胞がもともともっている系により選択的に分解する技術(以下本特集では“プロテインノックダウン技術”とする)が近年大きな注目を集めている.この技術を利用すると従来undruggableとされてきた標的タンパク質を分解することができ,新規医薬品開発への応用が期待されている.また標的タンパク質の機能やユビキチンによる細胞制御機構などを解析する基礎研究のツールとしても有用である.本特集では,この分野の最前線で活躍されている方々に,さまざまなタイプの化合物によるプロテインノックダウン技術とそれらを利用した創薬および基礎研究への応用例をご紹介いただいた.
はじめに

近年の疾患ゲノム学や疾患生化学の進歩によって治療のための標的分子が明確になるとともに,これらを標的とした治療薬(いわゆる分子標的薬)が数多く開発されるようになってきた.これら分子標的薬の成功例の多く(特に売上高の大きなブロックバスター)は小分子阻害剤と抗体であるが,小分子阻害剤は細胞内外の酵素タンパク質を主な標的とし,抗体は細胞外もしくは細胞表面のタンパク質を標的とする.したがって酵素活性のない細胞内タンパク質に対して有効な分子標的薬を開発することは一般的に難しく,細胞の全タンパク質のおよそ7割を占めるこれらのタンパク質はundruggableな標的とされてきた.これらundruggableな標的タンパク質に対する新しい創薬手法として,化合物を使って標的タンパク質を選択的に分解する技術(プロテインノックダウン技術)が最近注目を集めている1)2).これまでに報告されたプロテインノックダウン活性を示す化合物には,E3モジュレーター,キメラ化合物,DUB阻害剤がある.これらは,細胞内のタンパク質分解機構であるユビキチン・プロテアソーム系,あるいはオートファジー・リソソーム系を利用または制御することで標的タンパク質の分解を誘導する.以下でそれぞれの化合物について概説する(概念図).
1E3モジュレーターによるプロテインノックダウン
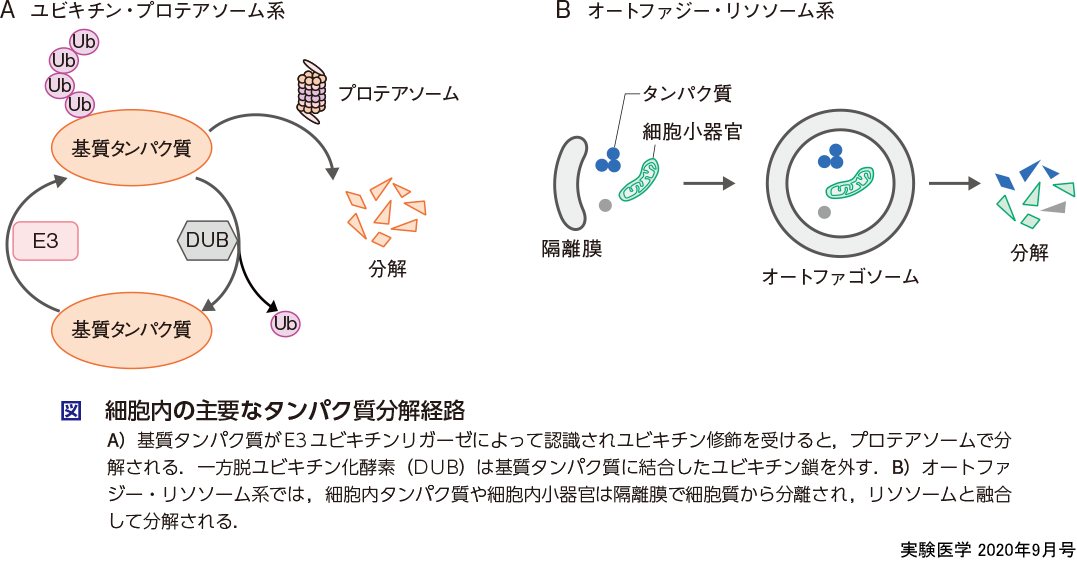
細胞内のタンパク質は主にユビキチン・プロテアソーム系およびオートファジー・リソソーム系で分解される(図).ユビキチン・プロテアソーム系はタンパク質を特異的に分解するシステムであり,分解の目印として4個以上のユビキチンが付加されたタンパク質は効率よくプロテアソームで分解される.ポリユビキチン鎖の長さは,鎖長を伸ばすE3ユビキチンリガーゼ(以下E3とする)と短くする脱ユビキチン化酵素(DUB)によって調節されている.一方オートファジー・リソソーム系は,細胞小器官や細胞質タンパク質を隔離膜で包み込んで内容物をまるごと分解するシステムである.これらのタンパク質分解系が小分子化合物によって制御されることが報告されたのは,比較的最近である.2005年に植物ホルモンオーキシンの受容体がE3の基質認識サブユニットTIR1であることが報告され,オーキシンがAux/IAAファミリーの転写抑制因子を分解することによって転写を活性化することが報告された3)(斎藤・鐘巻の稿).次いで2007年から2008年にかけてIAP(inhibitor of apoptosis protein)アンタゴニストやメチルベスタチンなどの小分子化合物がE3活性をもつIAPに結合してその自己ユビキチン化と分解を誘導することが相次いで報告された4).2010年にはサリドマイドの標的分子がE3の基質認識サブユニットであるセレブロン(CRBN)であることが報告され5),サリドマイド誘導体のレナリドミドがCRBNに結合することによってイカロスファミリーの転写因子が分解されることなどが明らかにされた(伊藤・半田の稿).同様にインディスラムなどのスルホンアミド化合物はDCAF15に結合しRBM39を分解する6)(大和・上原の稿).これらの小分子化合物はE3に結合してその機能を変化させることからE3モジュレーターといわれる.E3と標的タンパク質の結合を媒介することから分子糊と表現されることもある.E3モジュレーターによってユビキチン化された標的タンパク質はプロテアソームで分解される.これらと同様な機構でタンパク質分解を誘導する小分子化合物は他にも存在すると予想されており,最近サイクリン依存性キナーゼ阻害剤CR8が新しいE3モジュレーターであることが報告された7).
2キメラ化合物によるプロテインノックダウン
プロテインノックダウン技術のもう一つの研究の流れは,キメラ化合物を利用して標的タンパク質にE3を積極的にリクルートしようとするものである.
3プロテインノックダウン技術の新しい展開
キメラ化合物の亜型として,有本らはp-fluorobenzylguanineを分解タグとして利用しオートファジーを誘導するキメラ化合物
一方,ユビキチン化の逆反応を触媒する脱ユビキチン化酵素(DUB)は,タンパク質の安定化に寄与すると考えられており,DUB阻害剤は前述の化合物群とは別の機序で標的タンパク質を分解することができる14)(柴田・内藤の稿).
4プロテインノックダウン技術の特徴と創薬への展開
プロテインノックダウン技術を利用すると,最初に述べたundruggableな標的を含む細胞内タンパク質を分解することができる.またE3モジュレーターやPROTAC/SNIPERはE3の一部を利用して触媒的に標的タンパク質を次々と分解するため低濃度で長時間にわたって標的タンパク質を抑制できること,多機能タンパク質のすべての機能を抑制できることなど,阻害剤とは異なる薬理学的特徴を示す.またRNA干渉法を利用して標的タンパク質の生合成を抑制する核酸医薬(一般的には標的タンパク質の減少に数日かかる)と比較して,プロテインノックダウン技術ではすみやか(数分〜数時間)に標的タンパク質を減らすことができる.このような特徴を有するプロテインノックダウン技術は新しい創薬プラットフォーム技術として注目されるようになり,国内外でこの技術をもとにした創薬ベンチャーが相次いで設立され,大手製薬企業も参入して研究開発が近年急速に進んでいる(冨成・蒲の稿).E3モジュレーター型の化合物ではレナリドミドなどがすでに医薬品として承認されているが,キメラ化合物ではアンドロゲン受容体を分解するARV-110の臨床試験が2019年に開始された.
5今後の展望
プロテインノックダウン技術は十分実用的な新しい創薬プラットフォーム技術と認識されるようになってきたが,まだ歴史の浅い技術であり改良の余地は大きい.特に600種類以上あるE3のなかで現在利用できるのはCRBN,VHL,IAPをはじめとする数種類に限られており,その種類を増やすことは今後の大きな課題であると思われる.
また本技術はユビキチン基礎研究にも応用することができる.ユビキチンはプロテアソームによる分解の目印となるだけでなく,細胞膜タンパク質の内在化とリサイクリング,オートファジー,タンパク質の局在変化,DNA修復などさまざまな機能に関与するが,ユビキチンによってこれらの機能がどのように制御されているか未解明の点も多い.有力な仮説の一つはユビキチンコード仮説であり15),K48,K63,K11などの連結様式の異なるユビキチン鎖とこれを認識するデコーダータンパク質によって異なる細胞応答が仲介されるという考え方である.われわれはSNIPERがプロテアソームによる分解以外にも細胞膜タンパク質の内在化やマイトファジーを誘導する活性をもつことを見出しており,化合物によるユビキチン化をトリガーとして異なる細胞応答が誘導される機構を解析するケミカルバイオロジー研究への応用も想定している.
おわりに
以上大まかに述べてきたように,プロテインノックダウン技術は ① 新しい分子標的薬の開発,② 標的タンパク質の機能を解析する基礎研究ツール,③ ユビキチンの機能を解析するケミカルバイオロジー研究ツール,などさまざまな応用展開が可能な発展性の高い技術である.本特集をご覧になった多くの皆様に興味をもっていただければ幸いである.
文献
- Lai AC & Crews CM:Nat Rev Drug Discov, 16:101-114, 2017
- Naito M, et al:Drug Discov Today Technol, 31:35-42, 2019
- Kepinski S & Leyser O:Nature, 435:446-451, 2005
- Varfolomeev E, et al:Cell, 131:669-681, 2007
- Ito T, et al:Science, 327:1345-1350, 2010
- Uehara T, et al:Nat Chem Biol, 13:675-680, 2017
- Słabicki M, et al:Nature:doi:10.1038/s41586-020-2374-x, 2020
- Sakamoto KM, et al:Proc Natl Acad Sci U S A, 98:8554-8559, 2001
- Itoh Y, et al:J Am Chem Soc, 132:5820-5826, 2010
- Winter GE, et al:Science, 348:1376-1381, 2015
- Bondeson DP, et al:Nat Chem Biol, 11:611-617, 2015
- Ohoka N, et al:J Biol Chem, 292:4556-4570, 2017
- Takahashi D, et al:Mol Cell, 76:797-810.e10, 2019
- Shibata N, et al:Oncogene, 39:3867-3878, 2020
- Komander D & Rape M:Annu Rev Biochem, 81:203-229, 2012
参考図書
- ファルマシア第56巻第1号 特集「ケモテクノロジーが拓くユビキチン創薬研究の新潮流」,2020
- 生化学第92巻第1号 特集「非定型型ユビキチン鎖の生理機能」,2020
- 内藤幹彦:タンパク質の発現を制御する技術と医薬品開発への応用.国立医薬品食品衛生研究所報告,No. 137:pp1-5,2019
著者プロフィール
内藤幹彦:1987年東京大学大学院薬学系研究科博士課程修了.がん研究会がん化学療法センター,東京大学応用微生物研究所を経て,2009年国立医薬品食品衛生研究所部長.この間米国Sanford-Burnham医学研究所のJC Reed博士の研究室に留学(1998年).プロテインノックダウン技術をもとにした医薬品を開発することが今後の目標である.