概論
がん関連線維芽細胞の多様性の理解の難しさ
Key challenges in understanding the diversity of cancer-associated
fibroblasts
榎本 篤
Atsushi Enomoto:Department of Pathology, Nagoya University Graduate School
of Medicine(名古屋大学大学院医学系研究科腫瘍病理学)
がんの間質で増える線維芽細胞はがん関連線維芽細胞(cancer-associated fibroblastあるいはcarcinoma-associated fibroblast:CAF)とよばれる.1細胞解析技術の普及に伴い,CAFの多様性を議論する論文が増えたが,各CAF亜群の明確な機能については未解明のことが多く残されているのが現状である.CAF多様性の研究の難しさの理由として,1細胞解析技術のみではCAF亜群の機能はわからないこと,CAF多様性を明確な系譜の相違として説明できないこと,がんの種類によってCAF多様性が異なること,CAFの各亜群を特異的に除去するツールが限られていることなどがあげられる.本特集では多くのCAF研究者の中でも,CAFに発現する分子の機能解析やCAFの多様性の研究にかかわっている若手の研究者の方々にご解説をいただいた.これを機に多くの方にCAFの多様性に興味をもっていただき,分野間の共同研究が生まれることで,がん間質の本態の理解がすすむことを期待したい.
はじめに
がんは無秩序ながん細胞の増殖と周囲組織への浸潤であり,当然そこにはがん細胞による組織破壊と,それに応じた生体の修復反応が生じる.このときに増生する線維芽細胞の目的は細胞外基質(extracellular matrix:ECM)の産生による組織の修復である.問題は,皮膚の軽い傷の治癒反応などとは異なり,がん細胞による組織破壊が止むことはないため,修復反応と炎症反応が遷延することである(“wounds that do not heal”)(目澤・折茂の稿).がん細胞は周辺の線維芽細胞や免疫細胞を懐柔することで自らに有利な環境を形成し,このことががん細胞のさらなる進化と治療抵抗性に結びつくこととなる.CAFとは,前述の一連の事象において,活性化してはいるが正常線維芽細胞に近い状態の細胞(後述),慢性炎症によって影響を受けた線維芽細胞,がん細胞によって形質変化を誘導された(教育された)線維芽細胞,自らが産生したECMの沈着による組織硬化によってさらに活性化した線維芽細胞などが混在したものであり,その多様性は明確に異なる細胞系譜として規定されるものではなく,おそらく連続したスペクトラム上に位置づけられる細胞の集合体として理解されるものである.一方で,線維芽細胞とは異なる細胞系譜である中皮細胞やfibrocyteに由来するCAFも混在しており(小林の稿),がん組織のある瞬間のスナップショットの解析ではCAF多様性の本態の理解は困難である.CAFの研究の歴史,機能,マーカー分子,数々の分類法については本特集号の他稿や多くの総説1)〜8)に詳しいので,本概論では割愛させていただき,ヒトがん組織におけるCAFの見え方や,その多様性を理解する難しさについて,私見も交えて概説し,読者の厳しいご批判をいただく機会としたい.
1がん組織におけるCAFの見え方
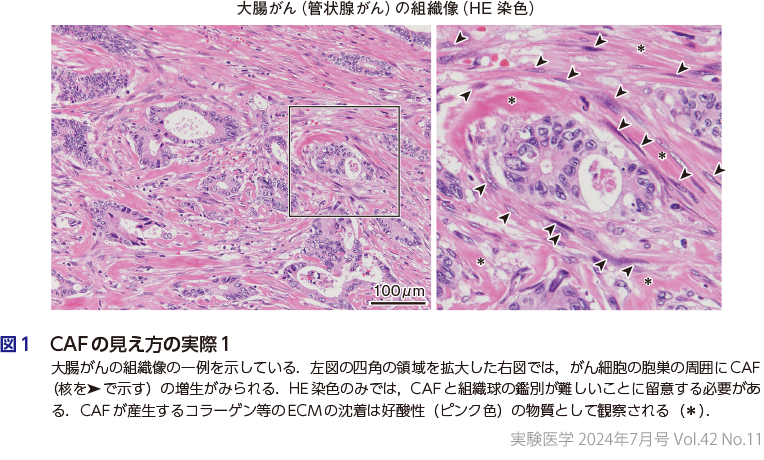
図1は大腸がんの漿膜下層への浸潤部位の組織像をヘマトキシリン・エオジン(HE)染色で示したものである.CAFががん細胞の胞巣を取り囲むように増生し,その周囲には好酸性(ピンク色)のECMの沈着(線維化)がみられる.CAFは形態のみからは組織球との区別が難しいことに留意する必要がある.
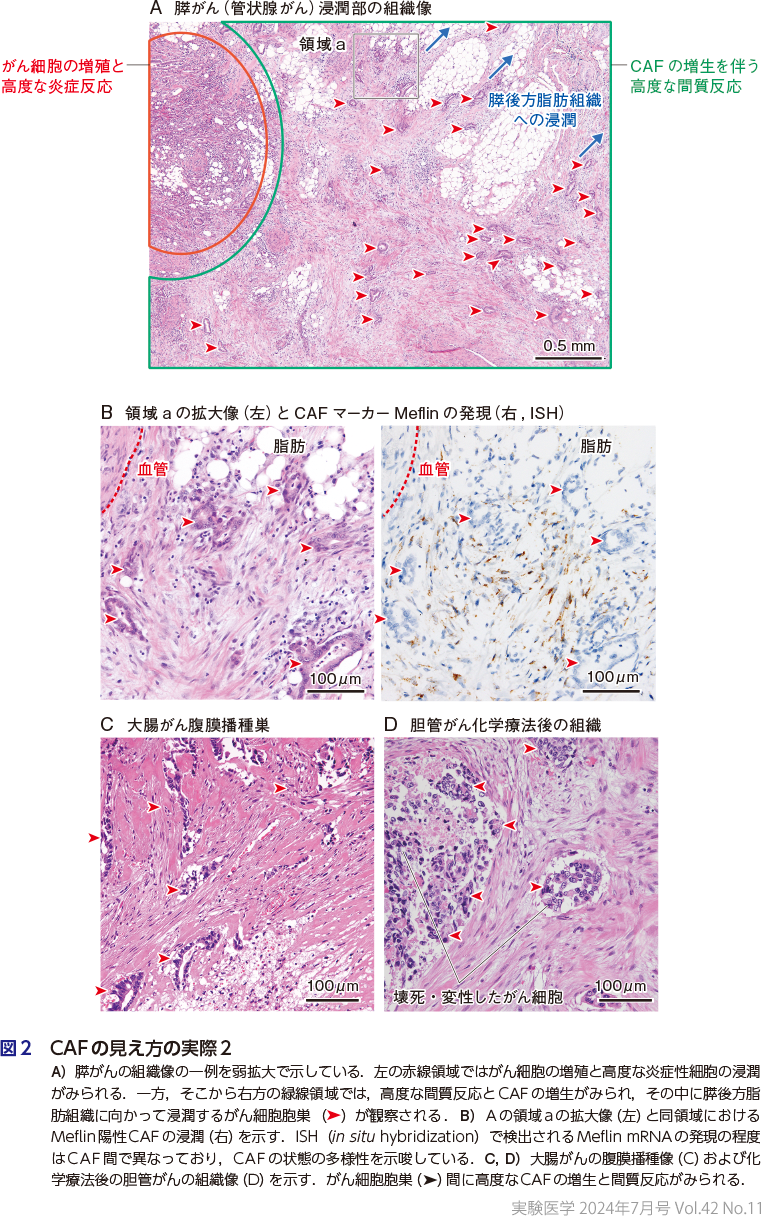
かわって,図2Aは膵がん(管状腺がん)の組織像を示したものである.左側の赤線で囲まれた領域では,がん細胞の増殖と炎症細胞の浸潤が顕著である.一方,ここから数mm右方に視野を移すと,膵外の脂肪に向かって浸潤するがん細胞の小胞巣が観察される(緑線で囲まれた領域,矢頭).ここでは炎症細胞の浸潤は比較的乏しく,かわりに高度なCAFの増生と線維化が観察される(図2B).このように,がんは部位によってきわめて多彩な組織像を示すことが多い.それぞれの領域に存在するがん細胞や炎症細胞の性質(がん細胞の遺伝子異常を含む),腫瘍血管の多寡,酸素分圧,ECMの量と質,硬さ・組織内圧などの種々の物理学的特性によりCAFの多様性が制御されている可能性,あるいは逆に,CAFががん細胞や炎症細胞の性質を制御している可能性が考えられ,これらの双方向的作用の分子機序の解明がCAF研究の中心的重要課題である2)〜8)(目澤・折茂の稿,加藤の稿,仁科らの稿,千場・石本の稿,春名らの稿).
CAFの増生はがん原発巣のみならず,転移巣でも観察される.図2Cは腹膜に播種した大腸がんの組織像であり,CAFの増生とECMの沈着により,がん細胞を上回る量の間質が形成されている.また図2Dは,抗がん剤の治療後に手術で摘出された胆管がんの組織像である.抗がん剤治療によってがん細胞は壊死あるいは変性しているが,その周囲には一見元気なCAFの増生が観察される.このようにCAFは抗がん剤抵抗性を示すことが知られており,したがって,抗がん剤治療後のがん再発にも深くかかわるとされている9).CAFは抗がん剤治療への曝露によって老化CAFなどにその形質を大きく変化させることもわかりつつあり(春名らの稿),各種治療によるCAFや間質の変容とその意義は本研究分野の今後のトピックの一つである10)11).
2CAFの多様性とがん促進性機能
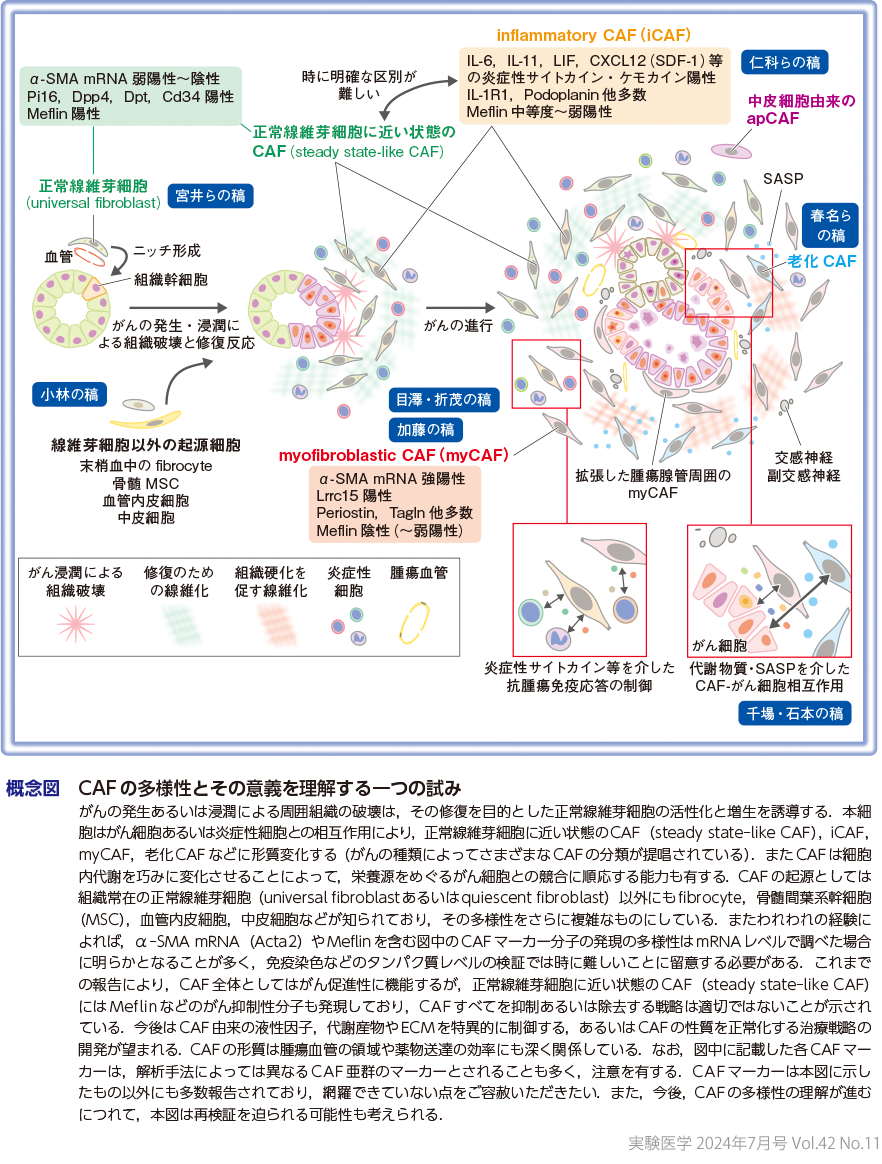
冒頭で述べたように,線維芽細胞の増生の目的は壊れた組織の修復であり,がんの問題点はそれが遷延することである.がん細胞の浸潤は周囲の組織を破壊し,これに応答して正常線維芽細胞の活性化と増生が開始される(概念図).これが初期段階のCAFの本態であり,膵がん自然発症モデルマウスを用いたわれわれの検証でも,膵がんの超初期には,正常線維芽細胞(に近い状態の)CAFが,本特集号でもたびたび解説されるmyCAF(myofibroblastic CAF)(目澤・折茂の稿,加藤の稿)に先んじて増生していた12).この初期に応答する正常線維芽細胞あるいはCAFが,がん細胞,炎症細胞との相互作用によりmyCAF(目澤・折茂の稿,加藤の稿),iCAF(inflammatory CAF)(仁科らの稿)や老化CAF(春名らの稿)に変化していくものと推定され(概念図),実際にこの細胞状態の遷移は1細胞解析データを用いた擬時系列解析でもみることができる.
また,修復反応の遷延化によって線維化が高度になると,組織はより硬くなる.あるいはがん細胞胞巣の増大や腺管構造の拡張によって周囲組織は圧排・伸展される.これらのメカノストレスに反応して,CAFは平滑筋アクチン(α-SMA)の高発現による収縮能を備えたmyCAF,mechanoresponsive CAF,あるいは筋線維芽細胞に形質変化する(概念図).さまざまな細胞から分泌されるTGF-βも正常線維芽細胞をmyCAFに形質変化させる強力な因子である(小林の稿).myCAFの増生とそれによるECMの高度沈着による硬化はさらにがん細胞の悪性度を上昇させること,間質圧を上昇させて薬物送達の効率を低下させることもよく知られている13)14).千場・石本の稿に詳しいように,CAFとがん細胞は細胞内代謝を巧みに変容させて,相手方の増生や生存に有利な環境をつくり出している(概念図).また,仁科らの稿で概説されるように,CAFは抗腫瘍免疫応答の強力な抑制因子でもある8)15)〜17).このように,CAFはがんの進展あるいは治療抵抗性を促進する強力な因子であり,多くの研究者あるいは製薬企業ががん治療薬の開発標的の一つとして期待する理由である.
3myCAFの機能に関する相反する仮説
目澤・折茂の稿,宮井らの稿に詳しいように,CAFががん抑制性に働く,あるいはCAFの少なくとも一部はがん抑制性の機能を有するという仮説は,膵がん自然発症マウスモデルにおいて,CAFの増殖因子であるSonic hedgehogを阻害する,あるいはα-SMA陽性細胞を人為的に欠失させるとがんの進行がみられたとの報告に基づいている.特に後者の報告により「myCAF=がん抑制性CAF」との論調も一部の総説にみられるが,現時点では別の解釈の可能性も残されている.再三述べているように,線維芽細胞の増生の目的はがん細胞の浸潤によって破壊された組織の修復である.CAF増生の人為的な欠失は,この修復プロセスを阻害する可能性があり,そのことが結果的にがんを進行させている可能性がある.すなわち,同じα-SMA mRNA陽性のCAF(発現レベルはさまざま)でもがん発生初期に増える細胞と後期に増える細胞,あるいは修復を目的に増える細胞とその目的を忘れた細胞ではがんの進展に与える影響が異なるのではないかとの考えである.実際,Turley博士のグループ(Genentech社)からの最近の報告では,myCAFに特異的なマーカーとしてLrrc15を同定し,Lrrc15陽性myCAFを人為的に欠失させると,正常線維芽細胞に近い状態のCAF(Pi16陽性のuniversal fibroblast)の増加とともに,膵がんの進展の抑制と抗腫瘍免疫応答の増強がみられ,myCAFががん促進性因子であることが示唆された17).ただし,ある一定のCAF亜群を人為的に欠失させる実験は,欠失そのものが腫瘍免疫微小環境に与える影響も考慮する必要があり,結果の解釈には慎重を要する.今後のさらなる検証が必要である.
4CAFの機能が発現する分子群の機能の総和によって決まる可能性
Turley博士らの報告は,正常線維芽細胞ががん抑制性の働きを有することをマウスモデルで最初に示した1999年のOlumiら(カリフォルニア大学サンフランシスコ校)の報告に合致するものである18).われわれも,これらの報告に一致する結果を得ており,正常線維芽細胞あるいはそれに近い状態のCAFに発現しているGPIアンカー型膜分子Meflinががん抑制性機能あるいは抗腫瘍免疫応答を増強する機能を有する可能性を報告してきた19)〜22)(宮井らの稿).一連のわれわれの検証から,CAFの多様性を論ずる場合には,myCAF,iCAF,apCAF(antigen-presenting CAF)など(あるいはこれ以外にも提唱されている多く)のCAF亜群に加えて,この「正常線維芽細胞に近い状態のCAF」を加えるといろいろなデータの解釈がしやすくなると感じている(概念図).実際,最近の包括的なマルチオミクス解析から存在が提唱された「steady state-like CAF」がこれに相当するもので,同CAFの量は治療の前後でダイナミックに変化することも報告された11).
ただし,われわれの検証によると,正常線維芽細胞あるいはsteady state-like CAFを欠失させても必ずしもがんの進行はみられない19).したがって,現時点では,前述細胞群=がん抑制性CAFとするよりは,CAFに発現するMeflinなどの機能分子ががん抑制性機能を有すると考えるほうが正確である(宮井らの稿).おそらくCAFの多様性は,がん促進性,がん抑制性と明確に分かれる機能によって説明されるものではなく,その細胞に発現する分子の機能の総和によって決まる「状態」であり,一連のスペクトラム上にのる細胞集合体である可能性が高い.最近の論文では,1細胞解析の結果のみに基づくCAF分類法が乱立気味である.一部の論文では,1細胞解析で同定されたCAF亜群の相対比率と,患者予後あるいは免疫細胞の浸潤パターンなどの間の相関に基づいて同亜群の機能を論ずるものもあるが,これらは必ずしもその亜群の機能の証明にはなっていない.個々の分子の丁寧な機能解析,あるいは各CAF亜群を特異的に欠失させる,あるいは抑制する検証が必要である.
おわりに
前述の通り,CAF全体を阻害する戦略は好ましくないとされており,現在はCAR-T細胞等による特定のCAF亜群の除去,あるいはCAF由来のECM,代謝物質あるいは液性因子の阻害,さらにはCAFのリプログラミング(normalization)などの戦略,さらにはこれらと免疫チェックポイント阻害剤との併用の効果等が研究機関,製薬企業による臨床試験で鋭意検証されているところである4)5)8)15).一方,がんの種別,分子分類あるいは患者ごとのCAFの多様性の違い,あるいは前述したように,抗がん剤や分子標的薬による治療後のCAFの多様性の変化については,報告は散見されるものの,未解明の点が多く残されている.生体から単離したCAFを硬いプラスチックディッシュ上で培養すると形質がmyCAF様に変わること,オルガノイド培養でCAFの長期間の維持が難しいこと,CAFマーカー分子の発現の多寡は免疫染色などのタンパク質レベルの検証では時に難しいこと,CAF亜群特異的な阻害剤開発や細胞除去実験を可能にするツールが乏しいことなどがCAF研究を難しくしており,常に複数の検証データを総合的に解釈して,各CAF亜群の機能を論じていく必要がある.最近普及しつつある1細胞レベルの空間トランスクリプトーム解析技術は,細胞単離のプロセスを経ずにCAFの遺伝子発現を調べることが可能であり,今までの技術では見えていなかったCAFの状態と局在に関する新たな情報が発見される可能性が高く,今後の報告の蓄積を待ちたい.
また,CAF研究で重要なのは,CAFの起源細胞となる細胞群(小林の稿),特に正常線維芽細胞の機能の解明である.線維芽細胞はECMの産生と配置により組織の基本構造を物理的に支持する機能の他,多くの臓器で組織幹細胞のニッチの形成にかかわることが知られている(概念図).一方,組織恒常性・可塑性(しなやかさ)の維持における線維芽細胞の機能の全容については不明の点も多く残されている.正常線維芽細胞からCAFへの状態遷移における “point of no return” の有無とそれを決定する機序も不明である.今後,正常線維芽細胞の機能に関する知見が蓄積することで,CAFを正常化あるいは適切に除去しうる治療法の開発に結びつくことを期待したい.
謝辞
これまでの研究の指導をいただいたすべての方々,共同研究者の方々,研究室のメンバーの方々に深謝いたします.
文献
- Cukierman E:Cancer Res, 81:4668-4670, doi:10.1158/0008-5472.CAN-21-2553(2021)
- Kalluri R:Nat Rev Cancer, 16:582-598, doi:10.1038/nrc.2016.73(2016)
- Kobayashi H, et al:Nat Rev Gastroenterol Hepatol, 16:282-295, doi:10.1038/s41575-019-0115-0(2019)
- Chen Y, et al:Nat Rev Clin Oncol, 18:792-804, doi:10.1038/s41571-021-00546-5(2021)
- Chen X & Song E:Nat Rev Drug Discov, 18:99-115, doi:10.1038/s41573-018-0004-1(2019)
- Ishii G, et al:Adv Drug Deliv Rev, 99:186-196, doi:10.1016/j.addr.2015.07.007(2016)
- Mezawa Y & Orimo A:FEBS J, 289:2429-2447, doi:10.1111/febs.15851(2022)
- Barrett RL & Puré E:Elife, 9:e57243, doi:10.7554/eLife.57243(2020)
- Ishii G & Ishii T:Hum Cell, 33:938-945, doi:10.1007/s13577-020-00417-8(2020)
- Caligiuri G & Tuveson DA:Cancer Cell, 41:434-449, doi:10.1016/j.ccell.2023.02.015(2023)
- Foster DS, et al:Cancer Cell, 40:1392-1406.e7, doi:10.1016/j.ccell.2022.09.015(2022)
- Miyai Y, et al:Cancer Sci, 111:1047-1057, doi:10.1111/cas.14346(2020)
- Ishihara S & Haga H:Cancers (Basel), 14:1049, doi:10.3390/cancers14041049(2022)
- Tanaka HY, et al:Cancers (Basel), 15:724, doi:10.3390/cancers15030724(2023)
- 榎本 篤,他:実験医学, 40:2580-2586, doi:10.18958/7133-00001-0000232-00(2022)
- 榎本 篤:実験医学別冊「もっとよくわかる!線維化と疾患」(菅波孝祥・田中 都・伊藤美智子/編),pp151-160(2023)
- Krishnamurty AT, et al:Nature, 611:148-154, doi:10.1038/s41586-022-05272-1(2022)
- Olumi AF, et al:Cancer Res, 59:5002-5011, doi:10.1186/bcr138(1999)
- Mizutani Y, et al:Cancer Res, 79:5367-5381, doi:10.1158/0008-5472.CAN-19-0454(2019)
- Kobayashi H, et al:Gastroenterology, 160:1224-1239.e30, doi:10.1053/j.gastro.2020.11.011(2021)
- Miyai Y, et al:Life Sci Alliance, 5:e202101230, doi:10.26508/lsa.202101230(2022)
- Ando R, et al:Cancers (Basel), 14:3315, doi:10.3390/cancers14143315(2022)
本記事のDOI:10.18958/7511-00001-0001641-00
著者プロフィール
榎本 篤:1998年名古屋大学医学部卒業.腎臓内科学(丹羽利充研究室),腎臓生理学(遠藤仁研究室),がんのRetシグナル伝達,神経系発生,血管新生(以上,髙橋雅英研究室)と分野を転々とし,現在は病理診断業務に従事しつつ,間葉系間質細胞や線維芽細胞に関する研究を行っている.病理形態学の専門性をアドバンテージにした仕事をしたいと願っているが,なかなか難しいと感じつつ,奮闘している.研究室ウェブサイト