概論
グルカゴン・インクレチンの新たな側面とその応用
New aspects of glucagon/incretins and their applications
北村忠弘
Tadahiro Kitamura:Metabolic Signal Research Center, Institute for Molecular and Cellular Regulation, Gunma University(群馬大学生体調節研究所代謝シグナル解析分野)
グルカゴン,GLP-1,GIPはアミノ酸配列や作用に類似点が多いペプチドホルモンであるが,互いに反対の作用を示す場合もある.また,もとになる遺伝子,分泌する細胞,血中半減期や血中濃度などには違いがある一方,それぞれの受容体はGタンパク質共役受容体(G protein-coupled receptor:GPCR)であり,細胞内シグナルは共通する場合が多い.最近,これらのホルモンの受容体作動薬,特に2つ,あるいは3つの受容体に同時に作用するdual agonistやtriagonistが開発され,臨床試験が進行中である.今後の糖尿病,肥満症,脂肪肝,慢性腎臓病など多様な疾患に対する主要薬剤となる可能性がある.
はじめに
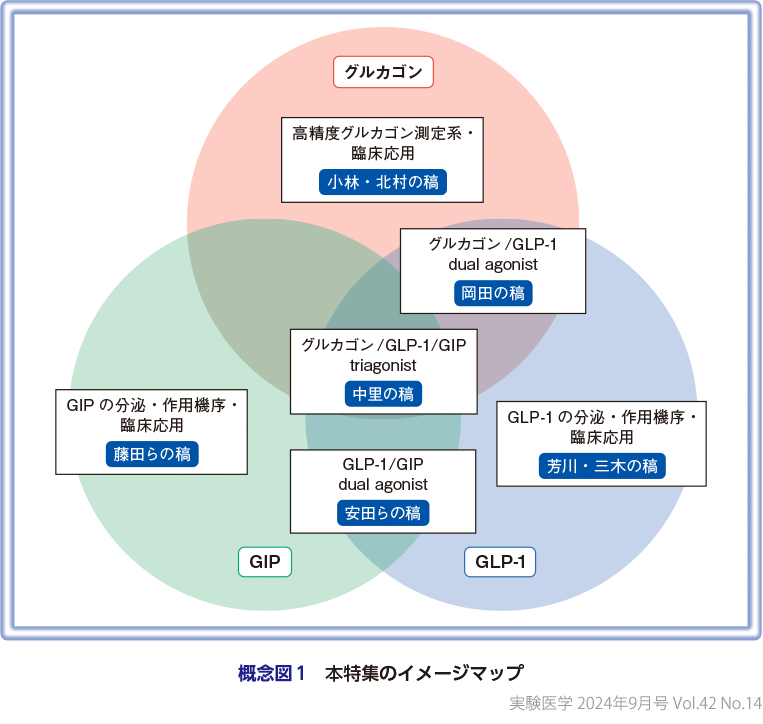
約15年前に国内で臨床応用されたDPP4阻害薬とGLP-1受容体作動薬のいわゆるインクレチン関連薬が糖尿病治療にパラダイムシフトを起こしたと言える.低血糖リスクがほとんどなく,安定した血糖改善効果を有するとともに,インスリン分泌促進作用に,グルカゴン分泌抑制作用を併せもつはじめての薬剤であった.一方その当時,グルカゴンは低血糖に対する治療薬としてしか認識されていなかった.しかしその後の15年間にGLP-1に加えて,GIPとグルカゴンにも新たな知見が多く得られ,血糖改善,体重減少作用に加え,心臓,腎臓,肝臓に対する多面的な作用が明らかにされるとともに,昨年のGLP-1/GIP dual agonistの臨床応用によって一気に注目度が増した.また,現在臨床試験が進行中のグルカゴン/GLP-1 dual agonistとグルカゴン/GLP-1/GIP triagonistに対する期待感も高まってきたタイミングで,これら3つの類縁ホルモンとその創薬について,現時点での知識を整理しておく目的で,これらのホルモンの専門家に分担して執筆をお願いした(概念図1).グルカゴンとインクレチン劇場の第2の幕開けとなるタイミングでの本特集を多くの読者と分かち合えれば幸いである.
1インクレチンの発見
最初に発見されたインクレチンは1902年に発見されたセクレチンである.セクレチンは十二指腸から分泌され,インスリン分泌促進作用があることが判明し,1932年にintestine secretion insulinを短くしてインクレチンと名付けられた.その後,グルコースを経口投与と経静脈投与して同じ程度に血糖値を上昇させた場合,前者の方がはるかに多くのインスリンが分泌されることが証明され,消化管から分泌されるホルモンのインクレチン効果※ に注目が集まった.その後,1970年に発見されていた42アミノ酸のペプチドホルモンにインクレチン作用があることが確認され,1973年にglucose-dependent insulinotropic polypeptide(GIP)と名付けられた.次に,1983年にプログルカゴンのアミノ酸配列が解明され,膵α細胞(以下α細胞)ではプロホルモン変換酵素2(PC2)の働きでプログルカゴンからグルカゴンが産生されるが,腸管細胞ではPC1/3の働きにより,同じプログルカゴンからGLP-1が産生されることが明らかとなった(図1A).その後,30アミノ酸をもつGLP-1(7-36)にインクレチン作用があることが確認され,現在ではGIPと並んでインクレチンの代表格となっている.

● GLP-1は本当にインクレチンなのか?
最近,GLP-1は本当にインクレチンなのかという疑念が提唱されはじめた.その根拠の1つがGLP-1の血中濃度の低さと食後の反応性の鈍さである.例えば,健常者の場合,食前に約10 pmol/LのGIPの血中濃度は食後には約110 pmol/Lまで上昇する.しかしながら,GLP-1は約10〜20 pmol/Lまでしか上昇しない1).また,GLP-1の血中での半減期は約2分であり,小腸から分泌され,門脈を通ってから動脈血の体循環に入って膵臓に到達する頃にはほとんどが分解されてしまっていると想像される.さらに興味深いことに,α細胞からもGLP-1が分泌され,膵ラ氏島内でβ細胞を刺激してインスリン分泌を促進するという報告がなされた2).また,GIPもC末端の12アミノ酸が欠損したGIP(1-30)がα細胞から分泌されていることが報告され3),GLP-1とGIPにインクレチンではないホルモン効果があることが注目されている.GIP(1-30)に関しては,本特集で藤田征弘先生に詳しく説明していただく(藤田らの稿).
2グルカゴンの発見
インスリンがBantingとBestによって犬の膵臓抽出物から発見されたのが1921年で,その2年後の1923年にKimballとMurlinがインスリンの粗精製物中に血糖上昇物質が含まれていることを発見し,グルカゴンと名付けた.その後,1953年にインスリンの51アミノ酸配列,1957年にグルカゴンの29アミノ酸配列が確定した.さらに,1959年にはインスリンとグルカゴンのラジオイムノアッセイ(radioimmunoassay:RIA)がほぼ同時期に開発され,両ホルモンの研究はインクレチンに比べると,はるかに早くからスタートした.しかしながら,その後の半世紀はインスリン研究が主流となり,グルカゴン研究に大きく差をつけ,あたかもインスリンが主役,グルカゴンは脇役のイメージが定着した.グルカゴン研究が進まなかった最大の理由は測定系が不正確だったからであるが,その問題は後に触れる.
● グルカゴンは消化管からも分泌されているか?
グルカゴンとGLP-1は同じ前駆体から合成されており,α細胞ではグルカゴンが,消化管細胞ではGLP-1が合成されるとされているが,前述したようにα細胞からもGLP-1が合成され,β細胞に対しパラクライン作用を発揮する.だとすれば,消化管細胞からもグルカゴンが合成され,分泌されていても不思議ではない.実際に1983年にプログルカゴンの全貌が明らかになる前から,消化管にもglucagon-like immunoreactivity(GLI)が存在することが多数報告されていた.また同時に,膵臓を切除すると血中グルカゴン濃度は測れなくなるのかについても長く議論になっていた.古くはゲル濾過法を用いた解析において膵切除患者の血中グルカゴンは検出できないと報告されていたが4),近年は,サンドイッチELISAによる測定で膵切除患者でも血中グルカゴン濃度は測定できており,糖負荷により血中グルカゴン濃度は健常者以上に上昇すると報告された5).そこで,この問題に終止符を打つべく,抗体による交差反応が除外できるLC-MS/MSを用いて膵切除患者の血中グルカゴン濃度を測定したところ,糖負荷前後のすべてのポイントで測定できなかったことから,グルカゴンは消化管からはほとんど分泌されていないと結論づけた6).
3プログルカゴン由来ペプチドホルモンとグルカゴン関連ペプチドホルモン
くり返しになるが,グルカゴンとGLP-1は同じ遺伝子産物のプログルカゴンから合成されるプログルカゴン由来ペプチドホルモンであり,アミノ酸配列にも相同性がある.一方,GIPは消化管から分泌されるインクレチンとしての共通性がGLP-1とはあるが,産生源の遺伝子は全く異なる.それにもかかわらず,GIPのアミノ酸配列はグルカゴンともGLP-1とも高い相同性をもった,いわゆるグルカゴン関連ペプチドホルモンである(図1B).これらのホルモンにはそれぞれに特異的なGタンパク質共役受容体(GPCR)が存在するが,その高い相同性から,ある程度のアフィニティで互いの受容体にも結合しうる.一方で,相同性が高いとはいえ,異なるアミノ酸配列の部分も存在することから,そのアミノ酸配列を認識する特異抗体を用いれば,互いに交差反応しない特異的な測定系(イムノアッセイ)を作成することが可能である.しかしながら,これら3つのホルモンのなかで,グルカゴンだけは図1Aに示すように同じプログルカゴンから産生されるオキシントモジュリンおよびグリセンチンとアミノ酸配列が100%重複しているため,通常のイムノアッセイでは抗体の交差反応を避けられない.さらに,オキシントモジュリンのN末端とグリセンチン(1-61)のC末端はグルカゴンと共通であり,グルカゴンだけを特異的に測定するにはN末端とC末端に対する両方の断端認識抗体を用いたサンドイッチELISAが必須になる.
最近,われわれはグリセンチンなどのグルカゴン関連ペプチドとの交差反応をほぼなくした最も正確なサンドイッチELISAの開発に成功した7).詳細は本特集の次稿(小林・北村の稿)で述べる.
4グルカゴン,GLP-1,GIPの作用
グルカゴン,GLP-1,GIPはアミノ酸配列の高い相同性から,さまざまな臓器で基本的には似たような作用をもっているが,一部では全く反対の作用を示す場合もあり,非常に複雑で,興味深い.それらの作用を概念図2にまとめてある8).先に述べておくが,これらの作用には生理的な血中濃度で発揮する,いわゆる生理作用と,その濃度を超えて,薬理学的濃度ではじめて発揮される,いわゆる薬理作用の両方が混在している.また,GIP受容体が膵臓,脂肪組織,脳に限局して発現しているのに対し,GLP-1受容体とグルカゴン受容体はほとんどの代謝関連臓器で発現しているが,GLP-1受容体は肝臓,グルカゴン受容体は骨格筋にはほとんど発現していないことから,肝臓におけるGLP-1作用と骨格筋におけるグルカゴン作用は直接作用ではなく,間接作用である可能性が高い9).
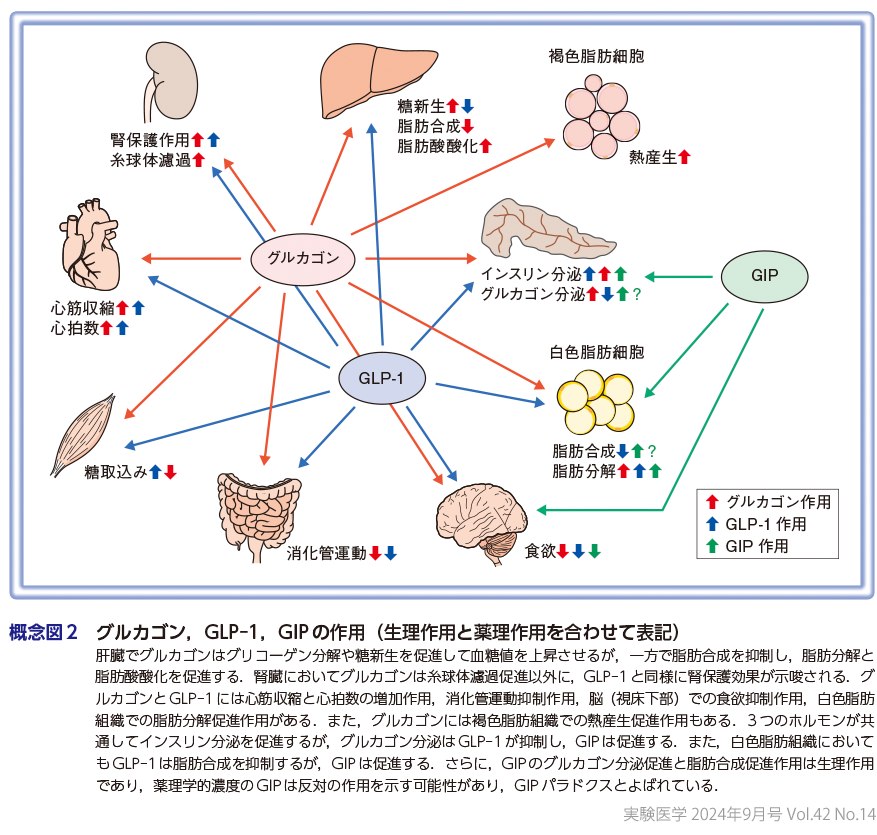
われわれが正確な測定系で評価した健常者の血中グルカゴン濃度は2〜10 pmol/L程度と低いことから,グルカゴンの主要な標的臓器は受容体が高発現している肝臓と腎臓と考えられる.肝臓でグルカゴンはグリコーゲン分解や糖新生を促進して血糖値を上昇させるが,一方で脂肪合成を抑制し,脂肪分解と脂肪酸酸化を促進することから,脂肪肝に対する治療効果が期待できる.腎臓においてグルカゴンは糸球体濾過量を亢進することが知られていたが,最近ではGLP-1と同じようにグルカゴンにも腎保護効果がある可能性が示唆された10).また,薬理作用の可能性が高いが,グルカゴンとGLP-1には心筋収縮と心拍数の増加作用,消化管運動抑制作用,脳(視床下部)での食欲抑制作用,白色脂肪組織での脂肪分解促進作用がある.さらに,グルカゴンには褐色脂肪組織での熱産生促進作用もあり,肥満の改善効果が期待される.これらのホルモンの最も重要な標的臓器は膵臓であるが,インスリン分泌に関しては,3つとも促進作用がある.一方で,グルカゴン分泌に関し,GLP-1は抑制し,GIPは反対に促進することが知られているが,両者のメカニズムは未解明である.また,白色脂肪組織に対してもGLP-1は脂肪合成を抑制し,GIPは反対に促進することが知られていたが,最近ではGIPがレプチン分泌促進を介して食欲の抑制とともに脂肪利用を亢進させることが報告されている11).さらに,GIPのグルカゴン分泌促進と脂肪合成促進作用は生理作用であり,薬理学的濃度のGIPは全く反対のグルカゴン分泌抑制,脂肪合成抑制を示す可能性が高く,GIPパラドクスとよばれている.
● 生理作用と薬理作用の細胞内シグナルの違い
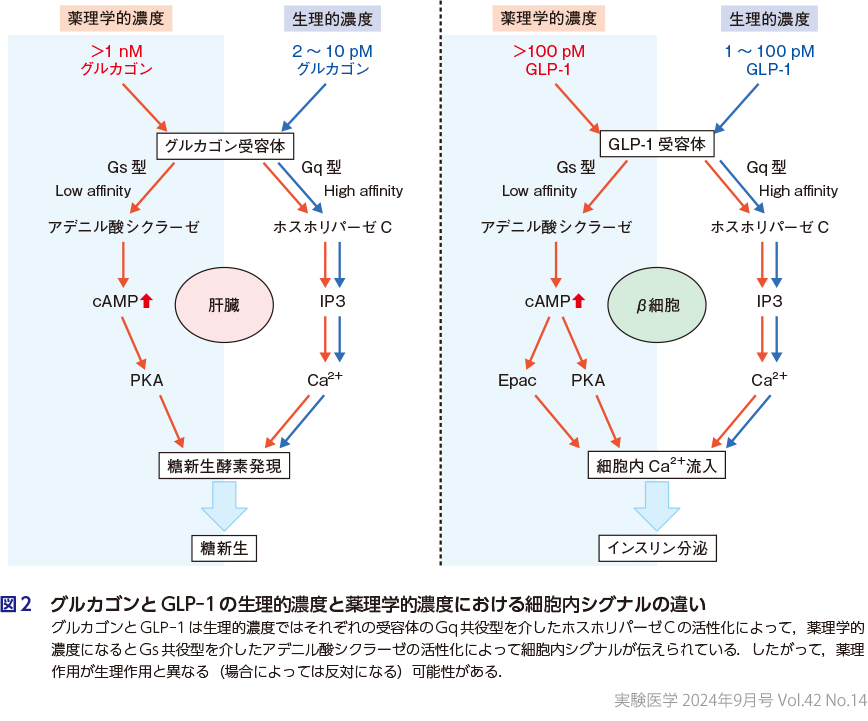
GIPパラドクスと同じようにグルカゴンとGLP-1も生理作用と薬理作用が異なる可能性が指摘されている.グルカゴンの濃度を変えながら,各臓器におけるグルカゴン作用を調べてみると,肝臓における糖新生は10 pmol/Lの濃度から亢進したが,脂肪分解と心筋収縮は1 nmol/Lからしか亢進せず,同時に測定した細胞内cAMP濃度も1 nmol/Lからしか亢進しなかった.これらのことから,グルカゴンは生理的濃度ではグルカゴン受容体のGq共役型を介してホスホリパーゼCを活性化し,Ca2+の流入による作用を発揮する一方,薬理学的濃度に達するとGs共役型を介してアデニル酸シクラーゼを活性化し,cAMP濃度上昇による作用が発揮されると考えられる(図2)12).GLP-1も1 pmol/Lの濃度でインスリン分泌促進が確認できるが,細胞内cAMP濃度の上昇は100 pmol/Lからしか観察されず,やはり生理的濃度ではGq共役型を介したホスホリパーゼCの活性化,薬理学的濃度ではGs共役型を介したアデニル酸シクラーゼの活性化が細胞内シグナルを伝えていると考えられる13).したがって,グルカゴン,GLP-1,GIPは生理作用と薬理作用を区別して考える必要があり,次項で述べる受容体促進薬の薬理学的効果をノックアウトマウス等の解析から得られたホルモンの生理作用に基づいて理解しようとすると矛盾が生じるので注意が必要である.
5グルカゴン,GLP-1,GIPの治療への応用
グルカゴン,GLP-1,GIPのなかで最初に糖尿病治療薬として臨床応用されたのはGLP-1である.国内では2010年に,1日1回あるいは2回の注射剤としてGLP-1受容体作動薬が臨床応用された.当初は血糖依存性のインスリン分泌促進作用とグルカゴン分泌抑制作用を併せもつ薬剤として注目されたが,注射剤のハードルが高く,同じインクレチン関連薬で経口剤のDPP4阻害薬に比べ,なかなか普及しなかった.その後,2015年に週1回の注射剤が発売され,一気に普及した.また,GLP-1受容体作動薬には体重減少効果や心臓,腎臓に対する保護効果といった膵外作用があることが明らかとなり,注射デバイスの改良や経口剤の開発もあり,糖尿病治療薬の主流となりつつある.詳細は本特集で三木隆司先生にご解説いただいた(芳川・三木の稿).GIPは前述したパラドクスの問題もあり,GIP受容体作動薬は臨床応用されていない.一方で,GLP-1/GIP dual agonist(受容体共作動薬)が昨年国内で臨床応用された.この薬剤はGIPパラドクスもなんのその,強力な血糖改善効果と体重減少作用を併せもち,消化器症状以外の重篤な副作用もなかったことから,GLP-1受容体作動薬で効果不十分であった症例にも有効に使用されている.本特集では矢部大介先生にご解説いただいた(安田らの稿).
一方,前述したように薬理作用も含めるとグルカゴンには食欲抑制,消化管運動抑制,熱産生亢進など,体重を減少させる作用がある.また,脂肪合成を抑制し,脂肪分解と脂肪酸酸化を促進することから,脂肪肝に対する治療効果が期待できるうえ,腎臓に対する保護作用をもつ可能性もある.しかしながら,グルカゴンの生理作用である糖新生促進作用により,血糖値は上昇してしまうため,単純なグルカゴン受容体作動薬ではなく,グルカゴン/GLP-1 dual agonistが開発されており,国内で第Ⅲ相の臨床試験が行われている.詳細は本特集で岡田裕子先生にご解説いただいた(岡田の稿).また,dual agonistと並行して,グルカゴン/GLP-1/GIP triagonistも臨床試験が進んでおり,詳細を中里雅光先生にご解説いただいた(中里の稿).
おわりに
インクレチンもグルカゴンも発見されて100年以上経つが,いまだに未解明なことが多く,まさに研究途上であり,これから多くの新しい知見が期待される.これまで研究が進まなかった理由はいくつかあるが,これらのホルモンの血中濃度を正確に測定する系がなかったことが大きい.また,これらのホルモンの生理作用と薬理作用を混同して考えてきたことも大きな問題である.さらに根本的な問題として,糖尿病の病態をインスリンを中心に考え過ぎていたこともあり,その意味では糖尿病の定義も改訂するべき時期にあるのかもしれない.今後,糖尿病に限らず,肥満症,脂肪肝,慢性腎臓病といった代謝性疾患全般の治療薬として,グルカゴン,GLP-1,GIPに関連する薬剤が複数臨床応用される可能性が高い.その際には,どの薬剤をどの患者に使用するか,個々の患者の病態に合わせた治療戦略が必要となる.本特集がこれらのホルモンの理解を深め,近い将来の個別化医療に貢献することを願っている.
文献
- Vilsbøll T, et al:Diabetes, 50:609-613, doi:10.2337/diabetes.50.3.609(2001)
- Nie Y, et al:J Clin Invest, 105:955-965, doi:10.1172/JCI7456(2000)
- Yanagimachi T, et al:Diabetologia, 59:533-541, doi:10.1007/s00125-015-3842-y(2016)
- Bajorunas DR, et al:Diabetes, 35:886-893, doi:10.2337/diab.35.8.886(1986)
- Lund A, et al:Diabetes, 65:585-597, doi:10.2337/db15-1541(2016)
- Kobayashi M, et al:J Diabetes Investig, 12:286-289, doi:10.1111/jdi.13325(2021)
- Kobayashi M, et al:J Diabetes Investig, 14:648-658, doi:10.1111/jdi.13986(2023)
- Brandt SJ, et al:J Intern Med, 284:581-602, doi:10.1111/joim.12837(2018)
- Brubaker PL & Drucker DJ:Recept Channels, 8:179-188(2002)
- Wang MY, et al:Cell Metab, 36:575-597.e7, doi:10.1016/j.cmet.2023.12.024(2024)
- Han W, et al:Diabetes Obes Metab, 25:1534-1546, doi:10.1111/dom.15001(2023)
- Rodgers RL:Curr Diabetes Rev, 8:362-381, doi:10.2174/157339912802083540(2012)
- Shigeto M, et al:J Clin Invest, 125:4714-4728, doi:10.1172/JCI81975(2015)
本記事のDOI:10.18958/7555-00001-0001447-00
著者プロフィール
北村忠弘:1989年,神戸大学医学部卒業後,神戸大学第2内科入局.’96年に博士課程修了.’99年から米国コロンビア大学糖尿病センターに留学し,主に膵臓,骨格筋,視床下部における転写因子FoxO1の役割を研究.2006年に帰国と同時に群馬大学生体調節研究所教授,’09年同大学代謝シグナル研究展開センター長,’13年同大学生活習慣病解析センター長兼任.現在は膵α細胞と視床下部に注目し,糖尿病と肥満の研究を行っている.最近,最も正確なグルカゴンサンドイッチELISAの開発に成功した.グルカゴンの新たな病態診断マーカーとしての活用をめざしている.
 正確なグルカゴン測定法開発の意義
正確なグルカゴン測定法開発の意義
ホルモン研究は正確な血中濃度の測定なしでは進歩しない.誤った測定結果からは血中動態を見誤るだけでなく,ホルモンの生理的意義や疾患における病態生理的意義まで間違って解釈してしまう.われわれは正確で,かつ簡便なグルカゴン測定法の開発に約10年かかった.このような地道で泥臭い仕事は即成果につながりにくいので避けたいところではあるが,どうしても正確にグルカゴンを測る必要があるとの信念で続けていた.開発に成功して本当によかった.(北村忠弘)

















