概論
生体イメージングで生命機能を“観る”“解く”“識る”“操る”
新たな技術開発の挑戦と生命科学研究への応用
Visualization, elucidation, identification, and manipulation of biological functions by intravital imaging techniques - Challenges of developing new technologies and their application to life science research
菊田順一
Junichi Kikuta:Division of Immunology, Department of Future Medical Sciences, Graduate School of
Medicine, Kobe University(神戸大学大学院医学研究科未来医学講座免疫学分野)
近年,生体イメージングを支える光学技術や光操作技術,AIを活用した生体画像解析技術などの技術革新が著しい.さらに,最新のオミクス解析技術と生体イメージング技術を融合して解析するなどさまざまな取り組みが行われることで,生体内の複雑な生命現象が次々と解明されつつある.生体イメージング技術は今や,生命科学の分野において幅広く活用され,将来の医療への応用も期待されている.本稿では,これらの生体イメージング技術の革新と,それらを利用した最先端の生命科学研究,臨床応用について議論したい.
はじめに
ヒトは推定37兆個の細胞からなる多細胞生物である.役割の異なる多種多様な細胞が複雑に相互作用して生体の恒常性が維持されている.生体内では,個々の細胞の遺伝子発現レベルは周りの環境に応じて変化していくため,生命現象の複雑なダイナミズムを理解するためには,生理的な環境を維持し,解析対象となる細胞の時空間情報を保持したうえで,個々の “生きた” 細胞の挙動を正確に捉えることが重要である.
これまでの生命科学研究において,生体情報を網羅的に評価するためのさまざまな技術開発が行われてきた.下村脩博士(2008年ノーベル化学賞受賞)が緑色蛍光タンパク質(green fluorescent protein:GFP)を発見して以来,さまざまな蛍光タンパク質や蛍光色素の開発が進み,特定の分子に蛍光タンパク質を付けて,その特定分子の挙動を可視化して解析する「蛍光イメージング」研究が急速に発展した.さらに,顕微鏡・レーザー技術が飛躍的に向上し,特に,低侵襲で深部組織の観察が可能な「二光子励起顕微鏡」1)2)の登場により,個体・組織を生かした状態で,“生きた” 細胞の動態を観察することが可能となった.生体イメージング技術で生体組織内部のありのままの様子を高解像度で可視化することで,生命現象の複雑なダイナミズムを理解することができるようになった.
近年,シングルセル遺伝子解析技術が飛躍的に進歩を遂げたことにより,組織に存在する各細胞の遺伝子発現を網羅的かつ詳細に調べることができるようになった.さらに,空間オミクス解析技術の登場により,空間解像度や解析可能な遺伝子数には改善の余地はあるものの,各細胞の空間的位置情報とオミクス情報を同時に解析できるようになってきた.いずれの解析手法も細胞の動きの情報が得られないという欠点があったが,最近では,生体イメージング技術と最新のオミクス解析技術を融合して,細胞の動きの情報と遺伝子発現の情報を統合的に解析する取り組みが行われ,生命機能の理解がいっそう進みつつある.
2024年のノーベル物理学賞および化学賞で,人工知能(artificial intelligence:AI)研究ならびにそれを生命科学に応用した研究が選ばれた.生体イメージング研究においても,AIが浸透しつつあり,深層学習・AIを活用した生体画像解析などの技術革新が著しい.膨大な画像データセットから特定の「動き」や「形」のパラメータを抽出するだけでなく,観察者のバイアスを排してさまざまな生物学的特徴量を抽出する手法が開発されている.
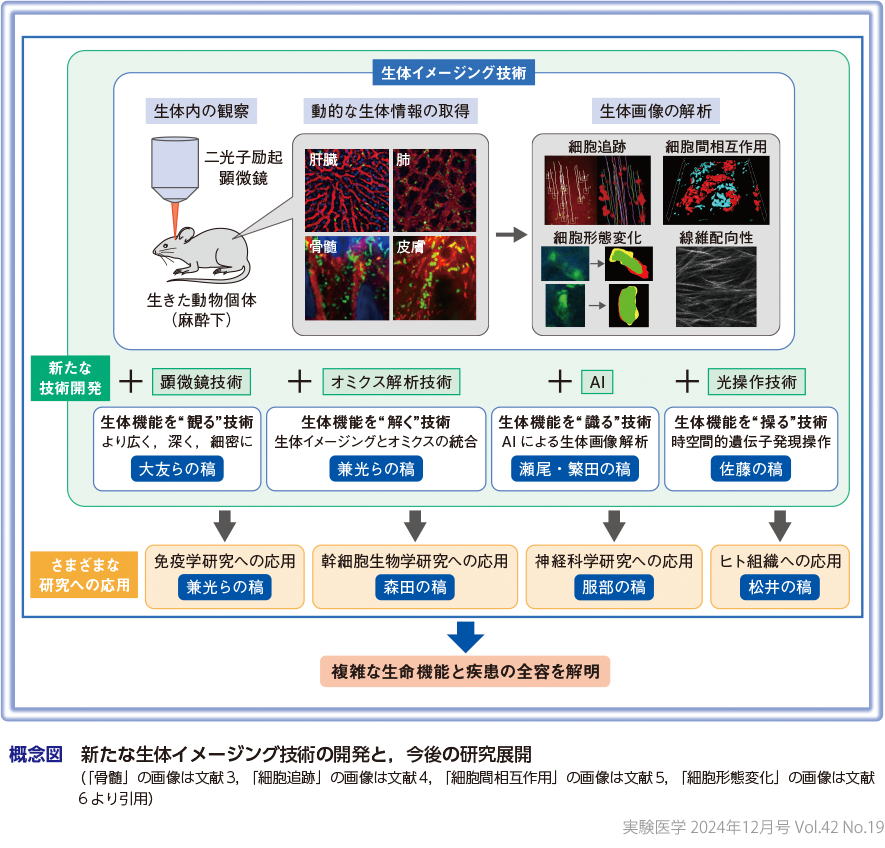
このように,オミクスやAIと組み合わせた生体イメージング技術は今や,生命科学の分野において幅広く活用され,将来の医療への応用も期待されている.本稿では,これらの生体イメージング技術の革新と,それらを利用した最先端の生命科学研究,臨床応用について議論したい(概念図).
1生体イメージングで見えるもの,わかること
❶ 何が見えるのか
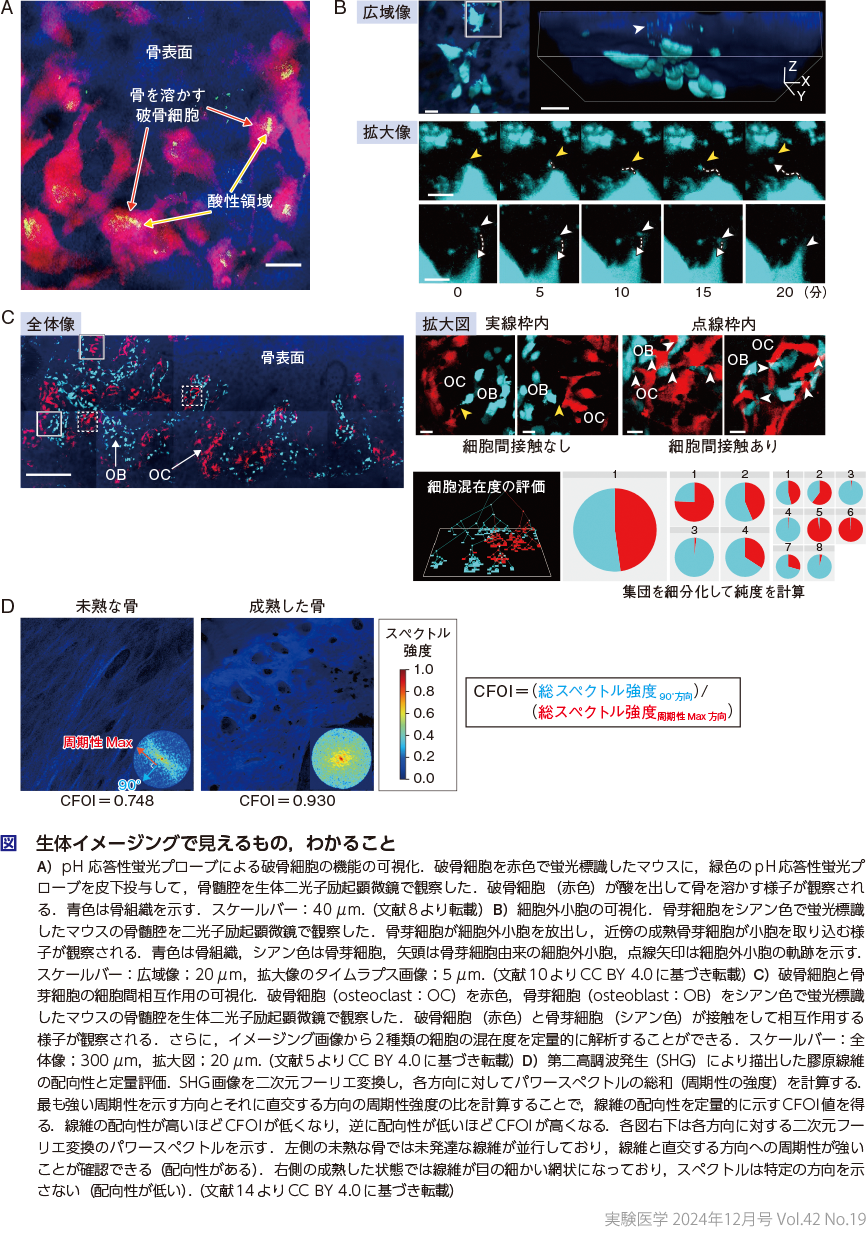
生体イメージングで主流の蛍光観察では,注目する細胞や分子を蛍光分子で標識することにより可視化するが,細胞の自家蛍光や線維から発せられる特殊な光(第二高調波発生,second harmonic generation:SHG)を用いることで,染色せずに観察できる技術の開発が進んでいる.さらに,近年,生体内情報を可視化するためのさまざまなツールが開発され,マウス生体内の細胞内外の物理化学的パラメーター(pHや温度,酸素濃度など)を計測できるようになってきている.われわれも,二光子励起顕微鏡をはじめとした最新の光学観察技術を駆使して,動物個体が生きた状態で,骨髄,肝臓,肺,皮膚などさまざまな生体組織内を観察し,生体内の細胞の動きや機能,細胞同士の相互作用をリアルタイムで解析してきた.例えば,“骨を壊す” 破骨細胞の機能をin vivoで可視化するために,破骨細胞が出す酸を感知して蛍光がonとなるpH応答性蛍光プローブを開発した7)8).その結果,破骨細胞が今まさに骨を溶かしている様子を捉えることに成功し,破骨細胞には機能的に異なる2種類の状態(骨吸収期と休止期)が存在し,両者を遷移することがわかった(図A)6).
❷ どの深さまで見えるのか
生体イメージングで観察可能な深度は,臓器によって異なる.脳は2 mm程度まで観察可能であるが,血流の多い臓器(肝臓や脾臓など)では,100 μmに満たない.骨に関しては,骨基質に含まれるリン酸カルシウム結晶が励起光を容易に散乱させるため,二光子励起に用いる近赤外レーザーを用いても深部まで到達させることは難しい.このため,われわれは骨基質が比較的薄く骨表面から骨髄腔まで約80~120 μmで到達できるマウス頭頂骨を用いている.
生体組織の内部は不均質かつ不透明なため,深部の生体情報を捉えることは困難であったが,近年,さまざまな種類の透明化技術が開発され,臓器全体を透明化し,全臓器スケールで個々の細胞の生体情報を捉えることが可能となった.本手法では,臓器を特殊な溶液で固定して解析する必要があるため,細胞の位置情報は保存されているものの,時間情報や細胞の動的な情報を得ることができないという欠点があったが,最近,生きた個体を透明化する全く新しい方法論が報告され,今後の生体イメージングへの活用が期待される9).
❸ どの大きさまで見えるのか
現在,生体イメージングで一般的に用いられている二光子励起顕微鏡の空間分解能は,100 nm程度である.われわれは,骨の生体イメージングにより,“骨を造る” 骨芽細胞が数百nmから1 μmの大きさの細胞外小胞を放出し,近傍の成熟骨芽細胞が小胞を取り込む様子を捉えることに成功し,骨芽細胞間で小胞を介したコミュニケーションが存在することを明らかにした(図B)10).さらに,最近では,細胞から放出されるエクソソームを可視化するために,エクソソームの蛍光標識にも挑戦している11).
また,近年,生体イメージング技術は感染症研究においても活用され,大きさが約100 nm程の高病原性インフルエンザウイルス12)や新型コロナウイルス(SARS-CoV-2;80〜220 nm)を蛍光標識することで,呼吸器感染症における免疫動態解析の取り組みも行われている.
❹ どのように解析するのか
生体イメージング画像の解析で用いられるパラメータは,“動き”(動く速さ)や細胞間の “相互作用”(細胞同士の接触時間)をはじめとして,その種類は多岐にわたる.そのため,われわれは,生体イメージングで得られた細胞動態に関する膨大な画像データを情報学的に処理し,客観的かつ定量性のあるパラメータを抽出する独自の解析手法を開発している.例えば,生体内で “骨を壊す” 破骨細胞と “骨を造る” 骨芽細胞が実際に相互作用する瞬間を捉えることに成功し,両者の物理的な細胞間接触が破骨細胞の機能を制御していることを明らかにした5).さらに,細胞の混在度(混ざり具合)を解析する手法を確立し,正常時には,破骨細胞と骨芽細胞は骨表面上で混ざり合うことなく局在するが,薬剤治療時には各細胞の局在が破綻し混ざり合うことがわかった(図C)5)13).また,骨基質の一種であるコラーゲン線維の“配向性”が骨の形成に伴って変化する様子を経時的に解析し,コラーゲン線維の配向性を定量的に評価する指標CFOI(collagen fiber orientation index)を開発した(図D)14).この解析方法を活用することで,骨形成が進行するにつれてコラーゲン線維の配向性が低くなることが明らかとなった.
2新たな生体イメージング技術の開発
現状の生体イメージング研究にはいくつかの解決すべき課題がある.これらの現状を打破するために,いま挑戦が進んでいる取り組みを紹介する.
❶ 生体機能を “観察する” 技術開発―より広く,深く,細密に
まず1点目の課題は,生体イメージング実験においては,実験者が主観的に選んだ視野(おおよそ200~300 μm四方)を経時的に観察することがほとんどであるため,組織全体のダイナミズムを時間軸で把握できていないという点である(木を見て森を見ず).そこで,大友らの稿では,生体機能をより広く,深く,細密に観察するために開発されてきた顕微鏡技術として,生きた標本を対象とした二光子励起顕微鏡法,透明化組織標本を対象としたライトシート顕微鏡法について紹介する.
❷ 生体機能を “理解する” 技術開発―生体イメージングとオミクスの統合
2点目の課題は,生体内の “生きた” 細胞の挙動を捉えることには成功したが,時空間情報を保持したまま,生体組織から特定の細胞のみを取り出して回収し,その細胞の遺伝子発現解析を行うことが難しいため,“見た” 生命現象を制御する分子メカニズムを正しく理解できていないという点である.そこで,兼光らの稿では,生体イメージング技術と最新のオミクス解析技術を融合して,細胞の動きの情報と遺伝子発現情報を統合的に解析する取り組みについて紹介する.
❸ 生体機能を “識別する” 技術開発―AIによる生体イメージング画像解析
近年,膨大な生体イメージング画像データやオミクスデータから,いかにして効率的に必要な情報を抽出するかが重要となってきている.最近では,情報科学的手法を駆使して,観察者のバイアスを排して画像データから客観的かつ定量性のあるパラメータを抽出する手法や,イメージングで画像を撮影しながら細胞の生物学的特徴量を自動で解析する手法などが開発されている.そこで瀬尾・繁田の稿では,近年,重要性がますます高まっているAIや機械学習を活用したイメージング画像解析技術について紹介する.
❹ 生体機能を “制御する” 技術開発―光操作技術の創出
生体イメージング技術は,生命現象をただ “観る” だけでなく,光で “操る” ことができる.特に,細胞・組織・個体を光で操作する「オプトジェネティクス(光遺伝学)」は,神経科学分野において革新的な進歩をもたらした.佐藤の稿では,ゲノムにコードされた遺伝子の塩基配列を光刺激で書き換えたり,遺伝子の発現を光刺激で活性化したりするための技術について紹介する.このような光操作技術を生体イメージング技術と組み合わせて用いることで,ライフサイエンスに大きな変革をもたらすことが期待される.
3生体イメージング研究の今後の展開
❶ 生体イメージングが拓く免疫学研究
免疫システムは,病原微生物からわれわれの体を守るためにつくられた,生命にとって必要不可欠な生体防御機構である.免疫学分野ではこれまで,さまざまな解析技術の進歩とともに,免疫応答にかかわる数多くの細胞や分子が次々と同定されてきた.兼光らの稿では,生体イメージングで明らかになった免疫現象について概説するとともに,生体イメージングとオミクス解析技術を組み合わせた最新の研究成果についても紹介する.
❷ 生体イメージングが拓く幹細胞生物学研究
従来,生体イメージングの観察時間は臓器によって異なるものの,技術的に長くても半日から24時間が限界である.組織の発生や細胞の分化など時間軸の長い生命現象の全過程を捉えるためには,同一の動物個体で特定の臓器内にいる標的の細胞を,数日から数週間の時間軸で観察することが必要である.近年,ライブイメージング技術の大幅な進展により,生体組織内のさまざまな幹細胞の動態を可視化することができるようになった.森田の稿では,ライブイメージングで明らかになった幹細胞の制御機構や機能,発生起源について紹介する.
❸ 生体イメージングが拓く神経科学研究
生体イメージングの多くは成獣マウスを使用するが,最近では,神経科学分野を中心に,二光子励起顕微鏡を用いて,新生仔や胎仔の生体内の組織深部の微細構造を高い解像度で観察する取り組みが行われている.服部の稿では,服部らが取り組む胎仔脳生体イメージングを活用した脳発生研究について概説するとともに,生体イメージングとオミクス解析技術・AIを組み合わせた最新の脳機能研究についても紹介する.
❹ 生体イメージングのヒト組織への応用
二光子励起観察では,線維構造や一部の細胞を非染色で経時的に可視化できるため,ヒトの生体組織を切らずに(生検せずに)解析することが可能である.そのため,近年,二光子励起観察をヒト病態の解析に応用する取り組みが進められている.松井の稿では,松井らが取り組む生体イメージングとAIを組み合わせたヒト組織の新たな病理組織診断について紹介する.
おわりに
生体イメージング技術の発展により,生きた動物の組織内で多種多様な細胞がそれぞれどのような動態を示し,どの細胞間で直接的な相互作用をし,その結果として細胞の機能・状態がどのように変化するのか,といった連続的なプロセスが明らかになってきた.また,オミクス解析技術が驚異的な発展を遂げたことにより,複雑な生命現象にかかわる細胞種の全容や分子メカニズムが明らかとなりつつある.今後,生体イメージングとオミクス解析技術・AIをうまく組み合わせて解析することで,病態特異的な病原性細胞が生体組織内で実際にどのように活動しているのか,その詳細を1細胞レベルで時空間的に明らかにすることができれば,疾患の本質を正しく理解し,有効な治療法の開発につながると期待される.
文献
- Denk W, et al:Science, 248:73-76, doi:10.1126/science.2321027(1990)
- Denk W & Svoboda K:Neuron, 18:351-357, doi:10.1016/s0896-6273(00)81237-4(1997)
- Kikuta J, et al:Proc Natl Acad Sci U S A, 110:7009-7013, doi:10.1073/pnas.1218799110(2013)
- Nishizawa S, et al:J Pharmacol Sci, 143:17-22, doi:10.1016/j.jphs.2020.01.001(2020)
- Furuya M, et al:Nat Commun, 9:300, doi:10.1038/s41467-017-02541-w(2018)
- Kikuta J, et al:J Clin Invest, 123:866-873, doi:10.1172/JCI65054(2013)
- Kowada T, et al:J Am Chem Soc, 133:17772-17776, doi:10.1021/ja2064582(2011)
- Maeda H, et al:Nat Chem Biol, 12:579-585, doi:10.1038/nchembio.2096(2016)
- Ou Z, et al:Science, 385:eadm6869, doi:10.1126/science.adm6869(2024)
- Uenaka M, et al:Nat Commun, 13:1066, doi:10.1038/s41467-022-28673-2(2022)
- Takeda N, et al:Inflamm Regen, 43:48, doi:10.1186/s41232-023-00299-x(2023)
- Ueki H, et al:Proc Natl Acad Sci U S A, 115:E6622-E6629, doi:10.1073/pnas.1806265115(2018)
- Morimoto A, et al:Nat Commun, 12:2136, doi:10.1038/s41467-021-22402-x(2021)
- Hashimoto K, et al:Sci Rep, 10:4751, doi:10.1038/s41598-020-61825-2(2020)
本記事のDOI:10.18958/7623-00001-0001787-00
著者プロフィール
菊田順一:2006年3月,大阪大学医学部医学科卒業.国立病院機構大阪南医療センターにて初期研修,リウマチ科後期研修を行う.’13年3月,大阪大学大学院医学系研究科博士課程修了(石井優教授).同年4月より,大阪大学大学院医学系研究科/生命機能研究科助教.’19年12月より,同准教授.’19年12月より,神戸大学大学院医学研究科教授(現職).これまで培ってきた独自の生体イメージング技術を活かして,線維化疾患をはじめとしたまざまな難治性疾患の発症初期における病態を解析し,「病気がなぜ引き起こされるのか」を明らかにすることで,副作用の少ない理想的な治療法の開発に役立てたい.
 誰も観たことがない世界に挑む
誰も観たことがない世界に挑む
リウマチ内科医として骨・関節破壊に興味をもっていた私は,2009年に大学院に進学し,骨破壊の原因となる破骨細胞の可視化に挑戦した.’10年6月7日,“生きた”成熟破骨細胞が生体内で骨を壊す現場を捉えることに成功した.そのときの感動は,いまでも鮮明に覚えている.世界中の誰よりも(もちろんボスよりも)早く,その瞬間に立ち会えることは,実験者の特権である.しかしながら,当時は誰も“生きた”成熟破骨細胞を観たことがなかったので,自分が観たものが本当に「破骨細胞」なのか,破骨細胞の「動き(形態変化)」をどのように解析するのか,論文のreviewerたちをどのように納得させるのか(一番苦労した点),答えを出すために試行錯誤をくり返した日々が今となっては懐かしい.骨折をしても元の形の骨に戻ることは当たり前ではあるが,細胞たちはどのように空間(骨の形)を認識して骨を修復しているのだろうか.生体イメージングで“生きた”細胞を観れるようになったからこそ,興味は尽きない.(菊田順一)