概論
生物学的年齢を測定することによる老化研究の未来
The advancing aging research through aging clock
早野元詞,寺尾知可史
Motoshi Hayano1)/Chikashi Terao2):Department of
Orthopaedic Surgery, Keio University School of
Medicine1)/Laboratory for Statistical and Translational
Genetics, RIKEN Center for Integrative Medical
Sciences2)(慶應義塾大学医学部整形外科学教室1)/理化学研究所生命医科学研究センターゲノム解析応用研究チーム2))
身体機能低下や疾患リスクの原因となる「老化」は,生活習慣や紫外線といった外的ストレスによる後天的要因に大きく影響を受ける.近年,老化はメチル化DNAをはじめとするさまざまな指標によってそれを定量し,暦年齢とは異なる身体機能やリスクを反映する生物学的年齢としての研究が進められている.生物学的年齢はAging Hallmarksの制御によって動的に変化することが知られており,高齢化社会に対する新しい治療薬や予防法の開発における指標としても着目されている.本稿では,生物学的年齢の概念と,近年の研究と開発の流れについて紹介する.
はじめに―老化研究の課題
「老化」が治療あるいは予防しうる疾患であるという考え方が近年急速に進み,学術的にも産業的にも大きな注目を集め,2022年だけで43,960件もの「aging」関連文献が新しく発表されている.これまでカロリー制限,DAF-2,Sir-2,ラパマイシン,SIRT6,p16/細胞老化といった老化を制御するさまざまな遺伝子,介入,細胞機能が発見されており,学術研究はもちろん,産業としてスタートアップ,企業等へ大きな投資を含めた幅広い関心を呼び込んでいる.
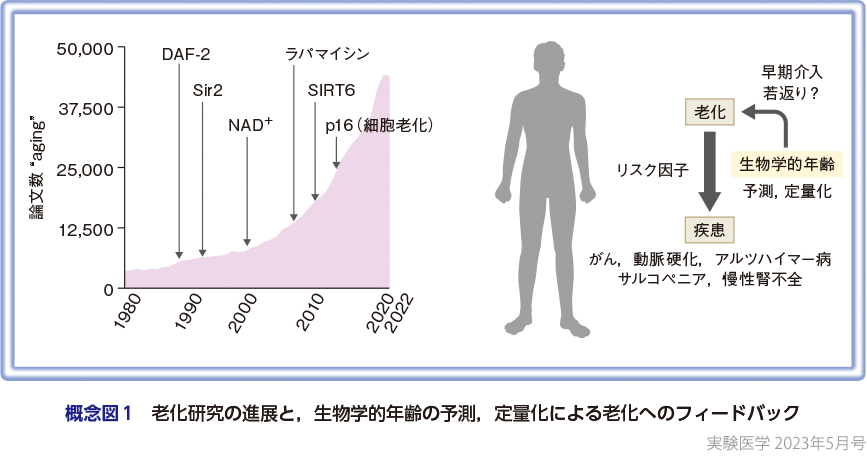
「aging」「老化」の定義はまだまだ議論の最中であるが,基本的な概念として形態的,生理的,機能的な時間に伴う変化を指し,多くの場合は細胞や個体の恒常性の破綻,疾患,死と連動している生命現象と捉えることができる1).特にヒトの場合,がん,動脈硬化,アルツハイマー病,サルコペニア,慢性腎不全など疾患や臓器の機能低下が加齢とともに生じることから,死亡の主要なリスク因子やQOLの低下の原因でもある.これら老化疾患を予測して早めに介入,予防することは医療効果と経済の観点からも非常に重要であるが,一方で老化の機序を解析し,生活環境,食生活などに応じて動的に変化する老化を定量,数値化する技術開発は十分に進んでいない.誰もが同じ速度で積み重ねる暦年齢ではなく,個体間で異なる生物学的年齢(身体や細胞の機能としての総合指標)の定義方法が次の10年における老化研究と医療の重要な課題と言える.そしてその生物学的年齢が介入によって若返ることが可能かどうかが広く興味を惹く課題となろう(概念図1).
1生物学的年齢の多様性
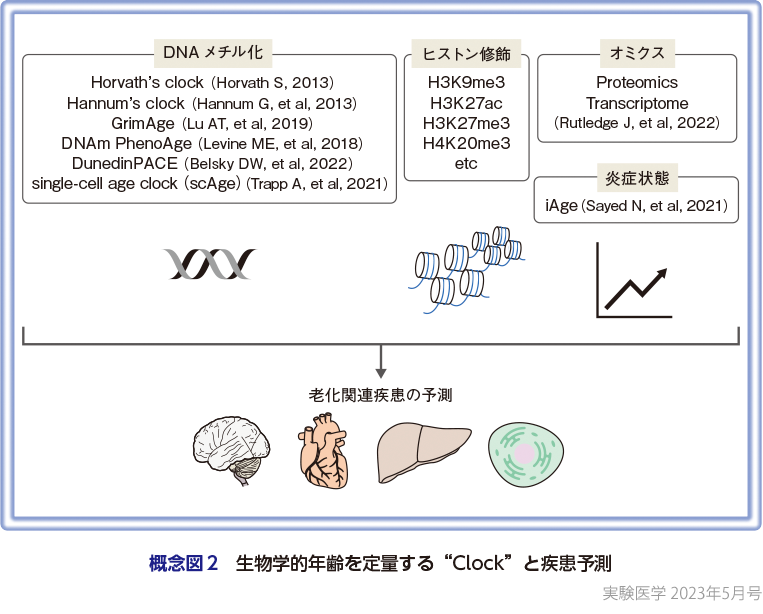
生物学的年齢の予測には,Horvath博士が2013年にDNA配列中のCpG部位におけるメチル化が年齢に伴って亢進されるサイトを特定し,“Aging Clock”と唱えたものが汎用されている2).現在,一般的にはHorvath博士の提唱する生物学的年齢の指標はHorvath’s clock,同年にHannum博士が提唱した血中メチル化DNAによる指標がHannum’s clockともよばれる3).その後,改良が進められて第二世代のメチル化DNAによる生物学的年齢指標であるGrimAge,DNAm PhenoAge,DunedinPACEなどが開発され,最近では1細胞レベルで若い細胞と,年寄りの細胞を分けるsingle-cell age clock(scAge)という試みもある4)〜8).そして,メチル化DNAだけではなくH3K9me3やH4K20me3などのヒストン修飾を介した遺伝子発現制御が,老化や疾患にかかわっていることから,全体としてEpigenetics Clockともよばれる9).
DNAやヒストン修飾と並行して,血液中の炎症性因子,ケモカインであるCXCL9が加齢とともに増加し,心臓疾患や,悪性脳腫瘍と相関があることも報告されており,炎症性時計(inflammatory aging clock,iAge)とよばれる10).現在では,年齢や疾患によって変化するバイオマーカーについて,タンパク質,代謝産物,転写パターンなどさまざまなAging Clock開発の試みが進められている(Omics Clock)11)(概念図2).
2生物学的年齢の因子と利用
2013年に老化を加速,抑制しうる細胞の機能として「Aging Hallmarks」とよばれる因子が9つに分類され,これまで300,000以上の文献によって解析が進められている.10年の節目の2023年にAging Hallmarksが同じ著者らによって更新され,現在は次の12因子となっている1);ゲノム不安定性,テロメア短縮,エピゲノム変化,タンパク質恒常性の喪失,オートファジーの機能低下,栄養センシングの異常,ミトコンドリアの機能異常,細胞老化,幹細胞の枯渇,細胞コミュニケーションの変化,慢性炎症,腸内細菌叢の変化.
遺伝子多型,ゲノムワイド関連解析(GWAS)はがんや糖尿病を含めた疾患のリスク予測,鑑別診断に有用な手法である.しかしながら,生涯変化しないDNA配列をもとにした身体機能低下や疾患のリスク予測には明確な限界がある.生物学的年齢のコンセプトは,GWAS結果を適用したpolygenic risk scoreなどの生涯動かない数値を代替するツールではなく,健康寿命のリスクや健康状態を,動的に変化する定量的指標として可視化することがその目的にある.そのために老化の加速,抑制にかかわっていることが知られているAging Hallmarksのような老化制御因子の活用が進められている.例えば,DNAのメチル化,細胞老化,ミトコンドリアの機能を含めた代謝などが健康状態を知る一つの指標として,生物学的年齢を推測しうる9)10).
カロリー制限は最も古くから知られる老化介入方法であり,1935年にカロリー制限によってマウスの寿命を延伸することが報告された12).IGF-1,NAD+,SIRT1,mTORなどカロリー制限やアミノ酸制限による寿命延伸の分子機序にかかわる遺伝子が1990年以降明らかとなり,栄養センサーを介した健康寿命延伸に対する介入試験が実施されている.しかしながら,カロリー制限を含めて老化への介入が社会的なムーブメントに至っていない大きな要因は,効果の観測に時間がかかるうえに数値化されて目に見えないことであろう.生物学的年齢を用いて健康寿命を定量化,見える化することはカロリー制限などの老化制御の介入を行う被験者だけでなく,老化制御をめざした医療機器,診断機器,医薬品,食品,プログラム医療機器等を開発する企業にとっても非常に重要なバイオマーカーとなることが想定される.
3Aging Clockを介した老化への介入と若返りへのアプローチ
メチル化DNAに代表されるAging Clockの中でもDNAやヒストンの化学修飾による老化の定量や予測を行うEpigenetics Clockが着目されている理由は主に生活習慣などによる動的な変化を反映していることにある.裏返すとEpigenetics Clockの分子機序を標的とした老化の予防や改善,誇張すれば「若返り」が可能なのではないか,という期待がある.しかしながら,生後の外的なストレスがDNA配列ではなくDNAやヒストンの修飾であるエピゲノムとして記憶され,老化を制御するのか,またEpigenetics Clockを巻き戻すことが可能かについては不明であった.
そこで筆者の早野はHarvard Medical SchoolのDavid A. Sinclairの研究チームにてJae-Hyun Yang(共同第一著者)らと,“ICE”(for Inducible Changes to the Epigenome)モデルを立ち上げ,エピゲノムを介した老化制御について解析を行っている13)14).ICEマウスではI-PpoⅠとよばれる15残基認識エンドヌクレースをタモキシフェン依存的に発現させることで,DNA損傷を時間,空間(臓器特異的)制御可能な形で誘導する.3週誘導したDNA損傷は1カ月後に観察した時点においては修復され,ゲノムシークエンスにおいてDNA変異は観察されない.しかしながら,ICEマウスは認知機能,筋肉,骨,皮膚などで老化様表現型が観察される.細胞老化,炎症に関与する遺伝子発現や,メチル化DNA(Aging Clock)の増加,H3K27acなどの臓器特異的なヒストン修飾の喪失がICEマウスの線維芽細胞や,筋肉組織において生じる.また,ヒストン修飾はFOXO1やCTCF結合領域特異的に変化するため,明確なDNA損傷依存的エピゲノム制御システムが存在することを示唆している.また米国ソーク生物学研究所のBelmonte博士は2016年に,in vivoにおけるOSKM(Oct4,Sox2,Klf4,Myc)を用いた老化表現型の改善,いわゆる若返り/rejuvenationをH3K9me3やH4K20me3といったエピゲノムの操作によって実施している15).その後,Sinclair博士らによってOSK(Oct4,Sox2,Klf4)を用いた視神経でのrejuvenationが報告されており,ICEマウスにおいてもOSK誘導によってメチル化DNA,ヒストン修飾(H3K9me3)の改善が観察される.2021年に東京大学の西村博士らは表皮幹細胞(EpiSCs)特異的なICEマウスをKrt14-CreERを利用して解析している.DNA損傷の誘導によってp21などの細胞老化マーカーと,Notch1/3等の発現が誘導され,p53-Notch経路依存的な分化と,表皮幹細胞の排除が生じることが示されている.エピゲノム変化は,細胞特異性,アイデンティティ,機能喪失につながることが予想され,今後臓器特異的な解析や,より詳細な生物学的年齢の分子機序解析が期待される.
4生物学的年齢の研究最前線
生物学的年齢は老化の研究と並行して更新されている.顔の表情や,動き,発声なども近年では認知症リスクや老化を予測するツールとして報告されており,将来的にAging Hallmarksといった生物学的指標に加えて,生活記録などさまざまな情報が組合わされることが予想される16)17).本特集においては,Aging Hallmarksにおいても記載されている複数の因子に加えて,臨床におけるフレイルの評価といった多様な生物学的年齢やバイオマーカーに関する知見を記載いただいた.
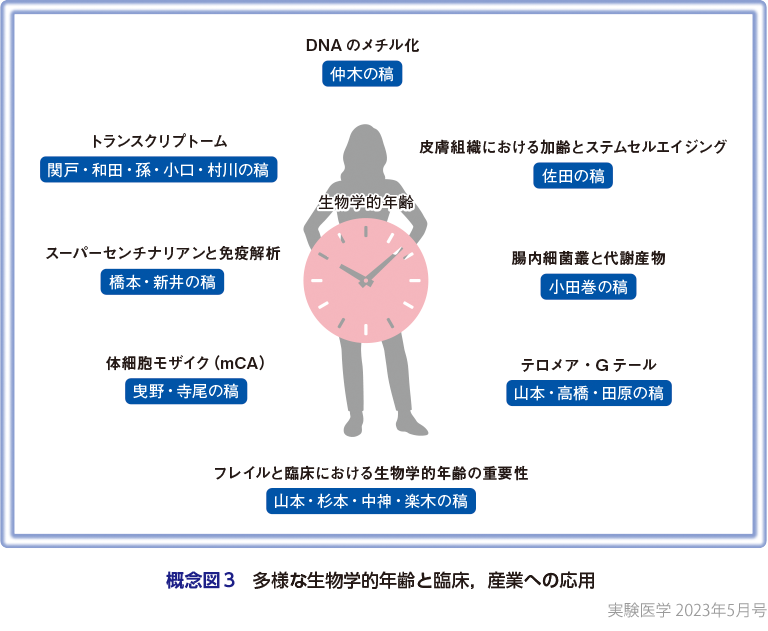
Horvath’s clockに始まるDNAメチル化状態による生物学的年齢に関して,その基本概念と種類,臨床への応用,現在の測定誤差を含めた課題について記載し(仲木の稿),トランスクリプトームによる詳細な加齢に依存した遺伝子発現の変化,特にシングルセルRNAシークエンシング,ロングリードシークエンシングなどの技術革新を背景とするエピジェネティクスやエンハンサーを介した遺伝子発現からみた老化の特徴について紹介する(関戸・和田・孫・小口・村川の稿).また,エピジェネティクスや遺伝子発現の変化は細胞のアイデンティティに影響し,幹細胞の自己複製や分化能力が低下する幹細胞老化(ステムセルエイジング)が観察される.特に皮膚は環境ストレスも多い中で微小環境と幹細胞の機能を解析するために優れた実験系である(佐田の稿).
また,日本が老化研究における有利な点として,健康診断を含めた生涯を通じた質の高い医療データの蓄積と,バイオバンクがある.100歳以上のセンチナリアンや,110歳以上のスーパーセンチナリアンなどの高齢者の研究も行われており,腸内細菌叢も解析の進む指標の一つである.Aging Hallmarksとして新たに加わった腸内細菌叢は,脂肪酸など代謝産物の変化や,加齢性疾患のリスクへの関与が示唆されている(小田巻の稿).腸内細菌叢も免疫制御にとって重要な因子であることが知られているが,実際にT細胞やB細胞などのリンパ球は高齢者で細胞の分布や受容体の発現が変化しており,高齢者における免疫能低下と疾患の指標として興味深い(橋本・新井の稿).加齢に伴うDNA長の変化も知られており,DNA損傷シグナルとテロメア・Gテールの変動と,疾患発症リスクや臓器不全についても議論いただく(山本・高橋・田原の稿).さらにDNA配列の多型ではなく動的な染色体レベルのゲノム変化である体細胞モザイク(mCA)が,造血系悪性腫瘍と死亡率の予測のツールとしても開発が進められており,血液サンプルを採取することで容易に生物学的年齢を数値化してリスクに対して定性的な介入が可能になるかもしれない(曳野・寺尾の稿).ただし,健康寿命やフレイルに関しては臨床的にどのように客観的に定量するのかが非常に難しく,最適な介入ポイントを臨床的に評価できる,新しいバイオマーカーの探索が必要である.特に薬剤介入の結果を評価することは,臨床開発にとっても重要な因子であり,デジタルデバイスを用いた評価を含めて期待されている(山本・杉本・中神・楽木の稿)(概念図3).
おわりに
老化研究はDAF-16/IGF-1といった寿命を伸ばす遺伝子を探索する1990年代の研究から,2000年代の哺乳類を含めた寿命の理解,2010年代の老化を要素分解して定量する概念の構築と介入の時代,そして2020年代は老化を動的に定量し,治療する時代へと突入している.世界的に30億ドルの投資をうけて2022年に立ち上げられたAltos Labs社は若返り/rejuvenationをめざし,Cambrian BioPharma社はAging Hallmarksのそれぞれの要素研究に対して投資を行いパイプライン化するなど,老化研究は基礎研究から産業へと動いている.そのような情勢において最も鍵を握っているのが老化の定量,生物学的年齢の測定である.日本は,豊富な健康・医療情報を有し,超高齢社会であるがゆえに多くのバイオバンクを含めた研究,開発のリソースとして期待されている.しかしながら,現在の日本はこれらを十分に活用できずに老化研究,産業としても世界に遅れをとっており,日本の存在感はかなり薄い.生物学的年齢は,老化を理解し,動的変化を定量することであり,今後国内においても独自の老化研究を行っている研究者や,先駆的検出技術,独自のアルゴリズム開発によって「健康寿命」に革新的イノベーションがもたらされることを期待している.
文献
- López-Otín C, et al:Cell, 186:243-278, doi:10.1016/j.cell.2022.11.001(2023)
- Horvath S:Genome Biol, 14:R115, doi:10.1186/gb-2013-14-10-r115(2013)
- Hannum G, et al:Mol Cell, 49:359-367, doi:10.1016/j.molcel.2012.10.016(2013)
- Belsky DW, et al:Elife, 11:e73420, doi:10.7554/eLife.73420(2022)
- Lu AT, et al:Aging (Albany NY), 14:9484-9549, doi:10.18632/aging.204434(2022)
- Trapp A, et al:Nat Aging, 1:1189-1201, doi:10.1038/s43587-021-00134-3(2021)
- Lu AT, et al:Aging (Albany NY), 11:303-327, doi:10.18632/aging.101684(2019)
- Levine ME, et al:Aging (Albany NY), 10:573-591, doi:10.18632/aging.101414(2018)
- Wang K, et al:Signal Transduct Target Ther, 7:374, doi:10.1038/s41392-022-01211-8(2022)
- Sayed N, et al:Nat Aging, 1:598-615, doi:10.1038/s43587-021-00082-y(2021)
- Rutledge J, et al:Nat Rev Genet, 23:715-727, doi:10.1038/s41576-022-00511-7(2022)
- McCay CM, et al:J Nutr, 10:63-79, doi:10.1093/jn/10.1.63(1935)
- Yang JH, et al:Cell, 186:305-326.e27, doi:10.1016/j.cell.2022.12.027(2023)
- Kato T, et al:Dev Cell, 56:3309-3320.e5, doi:10.1016/j.devcel.2021.11.018(2021)
- Ocampo A, et al:Cell, 167:1719-1733.e12, doi:10.1016/j.cell.2016.11.052(2016)
- Xia X, et al:Nat Metab, 2:946-957, doi:10.1038/s42255-020-00270-x(2020)
- Martínez-Nicolás I, et al:Front Psychol, 12:620251, doi:10.3389/fpsyg.2021.620251(2021)
本記事のDOI:10.18958/7239-00001-0000450-00
著者プロフィール
早野元詞:慶應義塾大学医学部整形外科学教室,特任講師.東京大学大学院新領域創成科学研究科メディカルゲノム専攻にて博士号(生命科学)を取得.2013年よりHarvard Medical School, David A. Sinclair研究室へ留学し,’14〜’17年までHuman Frontier Science Program, Long-term Fellow.’17年より慶應義塾大学医学部眼科学教室特任講師.「老化を理解と社会実装まで」を目標にスタートアップ上場,スタートアップ起業,ベンチャーキャピタル(VC)などにも携わる.老化研究とスタートアップの両方に興味がある方を募集中.
寺尾知可史:理化学研究所生命医科学研究センターゲノム解析応用研究チームチームリーダー.リウマチ科医であり,大学院生時代から自己免疫疾患のDNAマイクロアレイやHLAと臨床情報を組合わせた遺伝疫学的解析に従事.ゲノム解析をもとに難病の治療標的同定などを行ってきた.近年は体細胞変異,老化にも領域を広げ,大規模DNA,RNAデータを用いた解析を行っている.一緒に臨床応用を見据えた研究ができる人材を募集中.https://c-teraolab.com