概論
ゲノム編集治療の新時代到来
The new era in genome editing therapy
北畠康司,犬飼直人
Yasuji Kitabatake 1)/Naoto Inukai 2):Department of
Pediatrics, Osaka University Graduate School of Medicine1)/R&D
Research Global Advanced Platform, Takeda Pharmaceutical Company
Limited 2)(大阪大学大学院医学系研究科小児科学教室1)/武田薬品工業株式会社R&DリサーチGlobal
Advanced Platform2))
2020年にノーベル化学賞の受賞対象となったCRISPR-Cas9は,論文発表1)された当初からさまざまな分野での産業応用が期待されており,実際に驚くほどのスピードでその実用化が進んでいる.医療の分野もその1つであり,従来の一般的な治療法では満足できる治療効果が望めなかった疾患に対して,より効果的な治療法を提供できる画期的な技術として期待されてきた.2023年は,まさにその期待が現実化した年となった.CRISPR-Cas9を利用したゲノム編集治療薬である「exagamglogene autotemcel:exa-cel(CASGEVY)」は,ともにヘモグロビンの異常による遺伝性疾患である鎌状赤血球症と輸血依存性のβサラセミアを対象として,スイスのCRISPR Therapeutics社と米国のVertex Pharmaceuticals社によって開発され,2023年11月16日に英国で条件付き販売承認を取得した.exa-celは,CRISPR-Cas9技術を用いて患者の骨髄から採取した造血幹細胞の胎児ヘモグロビン(hemoglobin F:HbF)の発現を促すex vivoのゲノム編集治療薬であり,ゲノム編集技術を利用した世界で初めての治療薬となった.同年12月8日には,鎌状赤血球症を対象として米国でも承認を取得している.さらに,2023年10月18日には,米国のIntellia Therapeutics社が,トランスサイレチン型心アミロイドーシス(ATTR-CM)を対象として開発中のin vivoゲノム編集治療薬候補となるNTLA-2001の第Ⅲ相臨床試験を米国で開始したと発表した.これは第Ⅲ相試験に入る初めてのin vivoゲノム編集治療薬となる.また,異種移植の分野では,CRISPR-Cas9を用いて69個の遺伝子を編集したブタの腎臓をカニクイザルに移植し,2年に及ぶ生存を確認したという画期的な成果が,ハーバード大学とeGenesis社によって2023年10月のNature誌で発表された2).このように,欧米を中心としてゲノム編集治療の実用化が進んでおり,現在までに,世界ではすでに150件を超える臨床試験が実施されている.一方で,国内ではゲノム編集治療の臨床試験の実施はいまだに1件にとどまっており,世界との格差が浮き彫りとなっている.本特集では,国内のゲノム編集治療開発の活性化を期待し,ゲノム編集の医療応用に関連する分野でご活躍されている著名な先生方に寄稿いただき,それぞれの分野の現状とこれからの展望を中心に概説していただいた.
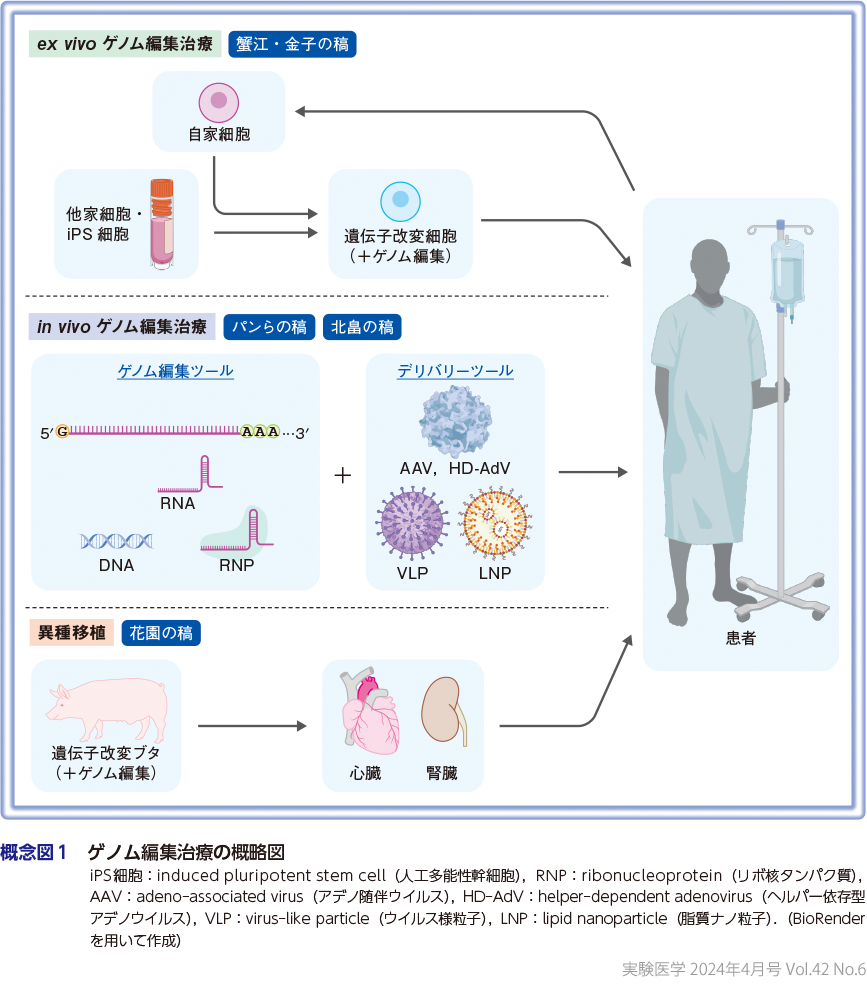
真下先生の稿では,ゲノム編集技術の総論として,歴史と現状について解説していただいた.特に,先生が開発されたCRISPR-Cas3を含むCRISPR-Casシステムについてより詳しく紹介いただき,技術の特徴だけではなく,医療応用の現状や将来の展望にわたって言及いただいた.次に,PartⅠ「いまそこにある課題とその解決法―ゲノム編集医療の真の実現化をめざして」(概念図1)として,まず,蟹江先生・金子先生の稿では,先生方が開発されているex vivoゲノム編集治療を中心に紹介いただいた.ともにノーベル賞を受賞した技術である,ゲノム編集技術とiPS(induced pluripotent stem)細胞技術の2つを利用したex vivoゲノム編集治療の現状について解説いただき,先生方が開発されている低免疫原性化を達成した免疫再生治療(免疫細胞に再生技術を応用した治療法)について紹介いただいた.パン先生らの稿では,パン イギュ先生,小島佑介先生,堀田秋津先生に,in vivoゲノム編集治療の「肝」となるデリバリー技術について概説していただいた.デリバリー技術の現状をご紹介いただき,in vivoゲノム編集治療の実現に向けた課題や今後の展望を,先生方が開発されたVLP(virus-like particle)システムであるNanoMEDIC(Nano Membrane-derived Extracellular vesicles for Delivery of macromolecular Cargo)やLNP(lipid nanoparticle)も含めて解説いただいた.北畠の稿では,われわれが開発している,ダウン症候群を対象としたCRISPR-Cas3とLNP技術を利用したin vivoゲノム編集治療について概説した.治療技術としてだけではなく,これまでの技術では作製が困難であったダウン症候群モデル細胞を,ゲノム編集技術を利用することにより作製し,病態のメカニズム解析に活用した実例も紹介する.花園先生の稿では,臓器ドナー不足の解決策として期待される異種移植,特にブタを用いた研究について,ハーバード大学とeGenesis社によって2023年10月のNature誌で発表された研究成果2)を紹介いただきながら,その歴史と現状,また国内の異種移植体制の課題についても言及いただいている.
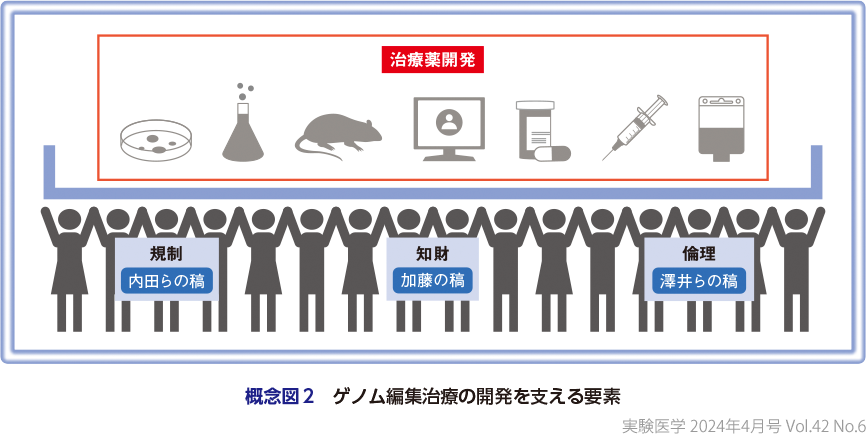
さらに,PartⅡ「社会実装にむけた課題とその解決法」(概念図2)として,内田先生らの稿では,内田恵理子先生,山下拓真先生,山本武範先生,井上貴雄先生に,ゲノム編集治療に関する国内の規制整備の現状について解説していただいた.「治験」と「臨床研究」の2つの臨床試験を実施するうえでの規制の違いや,「in vivo」と「ex vivo」ゲノム編集治療の規制の違いをわかりやすくまとめていただいている.さらに,ゲノム編集治療で求められる品質・安全性評価についても言及いただいた.加藤先生の稿では,ゲノム編集技術の知財戦略について概説していただいた.基本特許と改良特許,さらに世界と国内のゲノム編集技術に関する知財の現状を紹介いただき,今後の知財戦略の方向性にも言及いただいた.澤井先生らの稿では,澤井努先生,片岡雅知先生,金子未穂先生に,ゲノム編集技術の倫理やガバナンスについて解説いただいた.2023年に3回目の開催を迎えたヒトゲノム編集国際サミットの様子を紹介いただきつつ,研究・医療目的でのヒトゲノム編集に伴う倫理的課題,市民参画の動向と展望,今後の倫理・ガバナンスにおける方向性について言及いただいた.
近年,欧米を中心として,抗体医薬,核酸医薬,遺伝子治療,細胞治療など,つぎつぎと革新的な治療法が開発され,これまで治療の難しかった疾患の治療に大きく貢献した.一方,国内の状況をかんがみると,革新的な治療法の開発という面では,欧米に後塵を拝している感が否めない.冒頭にも述べたが,残念ながらゲノム編集治療においても同様の状況にあるとわれわれは危惧している.しかしながら,国内においても,本特集で執筆していただいた先生方をはじめとした研究者が,画期的な治療法開発に挑戦し,その「種」を強い信念をもって育てている.われわれは,国内の現状を踏まえ,欧米との差を埋めるためには,産・官・学・患・民が一体となり,その「種」を新しい治療法の創出につなげることが重要であると考える.本特集が,国内のゲノム編集治療開発を活性化するために投じられた一石となれば幸いである.
最後に,ご多用にもかかわらず寄稿いただいた執筆者の方々,企画から編集まで精力的にサポートいただいた羊土社実験医学編集部の多大なるご尽力に深甚なる感謝の意を表します.
文献
- Jinek M, et al:Science, 337:816-821, doi:10.1126/science.1225829(2012)
- Anand RP, et al:Nature, 622:393-401, doi:10.1038/s41586-023-06594-4(2023)
本記事のDOI:10.18958/7431-00001-0001379-00
著者プロフィール
北畠康司:1995年大阪大学医学部を卒業.その後は一貫して,小児科医として臨床診療に従事しつつ小児の知的発達とその障害に興味をもち研究を続けている.京都大学での大学院時代は中西重忠教授に,そして科学技術振興機構さきがけ研究員の頃は研究総括の西川伸一先生に,基礎研究のなんたるかを教え込まれた.2024年より大阪大学大学院医学系研究科小児科学教授.これからの10年のあいだにダウン症候群における初めての遺伝子治療法の開発をめざしている.
犬飼直人:2004年東京工業大学大学院生命理工学研究科博士課程修了,工学博士.同年武田薬品工業株式会社に入社し,創薬研究に従事.’09年から1年間,英国Oxford Centre for Diabetes, Endocrinology and Metabolism(OCDEM)での研究期間を経た後,’16年から京都大学iPS細胞研究所(CiRA)との共同研究プログラムT-CiRAにて,「ゲノム編集技術と生体内送達技術を利用した,デュシェンヌ型筋ジストロフィーに対する新規遺伝子治療法の開発研究」に従事している.